L'orbitale molecolare è una zona dello spazio occupata dagli elettroni di legame, direttamente coinvolti in un legame chimico di tipo covalente. In accordo alla teoria dell'orbitale molecolare, gli elettroni che formano un orbitale molecolare possono contribuire alla stabilità della molecola, ad esempio interponendosi tra i nuclei atomici che possiedono carica positiva, oppure destabilizzarla. In altre parole, si formano due tipi di orbitali molecolari, uno definito legante che contiene gli elettroni di legame, mentre un altro di antilegame, che contiene gli elettroni di antilegame.
L'orbitale molecolare di legame è a bassa energia e, per questo motivo, stabilizza la molecola mentre l'orbitale molecolare di antilegame è ad alta energia e la destabilizza. L'ordine di legame, che si ricava dal numero di elettroni presenti nei due diversi orbitali molecolari, serve a determinare il numero di legami covalenti della molecola. Allo stesso modo, qualora l'ordine di legame sia pari a zero, il risultato indica che la struttura molecolare non è ammissibile giacché non possono esistere molecole formate da zero legami covalenti.
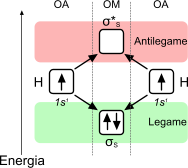
Orbitale molecolare dell'idrogeno. Gli elettroni presenti nell'orbitale di legame stabilizzano la molecola, mentre, per il caso dell'idrogeno molecolare, non esistono elettroni di antilegame.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?