L'elettronegatività di un atomo rappresenta la capacità di attrarre verso di sé elettroni di legame. All'aumentare dell'elettronegatività aumenta la capacità di attrazione degli elettroni di legame.
Elettronegatività e tavola periodica
Il valore di elettronegatività di un atomo, all'interno dello stesso periodo, aumenta da sinistra verso destra; di conseguenza in un periodo gli atomi con numero atomico maggiore sono più elettronegativi degli atomi con numero atomico minore. Considerando il gruppo, invece, l'elettronegatività diminuisce con l'aumentare del numero atomico. Ad esempio il carbonio, presente al secondo periodo della tavola periodica, è meno elettronegativo dell'ossigeno che è collocato nel medesimo periodo. Lo zolfo, numero atomico 16, è presente nello stesso gruppo dell'ossigeno e, rispetto ad esso, è meno elettronegativo.
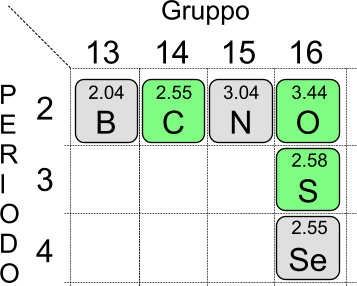
La figura sopra riportata identifica i tre elementi presi in esempio. L'ossigeno è più elettronegativo del carbonio e dello zolfo.
Elettronegatività e raggio atomico
Il raggio atomico è correlato alla elettronegatività. Maggiore è il raggio atomico minore è l'elettronegatività. Il carbonio possiede un raggio atomico maggiore dell'ossigeno che, difatti, è maggiormente elettronegativo. All'aumentare del periodo aumenta il raggio atomico e diminuisce l'elettronegatività, all'aumentare del gruppo diminuisce il raggio atomico e aumenta l'elettronegatività.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?