Il raggio atomico è una proprietà intrinseca dell'atomo che misura la distanza tra il nucleo e lo strato più esterno del guscio elettronico. È una delle proprietà periodiche degli elementi chimici.
Non è semplice definire il limite esterno del guscio degli elettroni. Per questo motivo, il raggio atomico è idealmente calcolato come la media della distanza tra il nucleo e gli orbitali più esterni del guscio, oppure come la metà della distanza rilevabile tra un nucleo di un atomo e il nucleo di un altro atomo, legati attraverso un legame covalente.
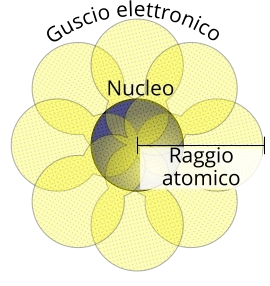
Raggio atomico di un atomo. Schematizzazione del nucleo e del guscio elettronico.
Proprietà periodiche del raggio atomico
Il raggio atomico aumenta all'aumentare del gruppo della tavola periodica e diminuisce lungo il periodo. L'analisi del gruppo, infatti, permette di stabilire all'aumentare del numero atomico e, di conseguenza, del numero di elettroni presenti negli orbitali il raggio atomico, a sua volta, risulta essere maggiore. Nel gruppo, gli elettroni esterni si trovano molto lontani dal nucleo e, inoltre, risentono meno dell'attrazione dello stesso per via dell'effetto di schermatura operato dagli elettroni dei livelli sottostanti.
Nel periodo, invece, il raggio atomico tende a diminuire. La spiegazione, in questo caso, non riguarda il numero atomico che, tende ugualmente ad aumentare, ma la carica nucleare che esercita una maggiore attrazione poiché gli elettroni esterni occupano il medesimo livello energetico.
Ad esempio, l'alluminio, ha un numero atomico pari a 13 (Z=13) e possiede un raggio atomico superiore rispetto al cloro che ha un numero atomico pari a 17 (Z=17). Gli elettroni dell'alluminio e del cloro, tuttavia, sono presenti nello stesso livello energetico e, per questo motivo, sono maggiormente attratti dalla carica positiva del nucleo del cloro rispetto all'attrazione che esercita il nucleo dell'alluminio verso i propri elettroni.
Misurazione
La misurazione de raggio atomico è molto complessa e si basa sulle tecniche di diffrazione a raggi X oppure sulla spettroscopia. Questi metodi sono definiti indiretti poiché utilizzano una misurazione quantitativa diversa dall'analisi diretta della distanza per ottenere una stima di quest'ultima.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?