L'equilibrio chimico, o semplicemente equilibrio, in una reazione chimica reversibile, è lo stato nel quale la concentrazione dei reagenti e dei prodotti di reazione rimane costante. In altre parole, quando in una reazione reversibile la velocità di sintesi dei prodotti equivale alla velocità di demolizione degli stessi.
In altre parole, temperatura costante, l'equilibrio chimico tra i prodotti A e B, nelle concentrazioni a e b porta alla formazione dei prodotti C e D, nelle concentrazioni c e d.
$$aA + bB \rightleftharpoons cC + dD$$
Ad un certo punto, dipendente temporalmente dalla velocità di reazione, la concentrazione dei prodotti e dei reagenti si manterrà stabile. La velocità di formazione dei reagenti, in quel momento, sarà perfettamente uguale alla reazione inversa di formazione dei prodotti. L'affermazione è valida a patto che:
- Il sistema sia chiuso, dunque non vi sia possibilità né di introdurre né di sottrarre prodotti e reagenti;
- La temperatura rimanga costante;
È possibile osservare, attraverso un grafico, l'andamento delle concentrazioni di prodotti e reagenti.
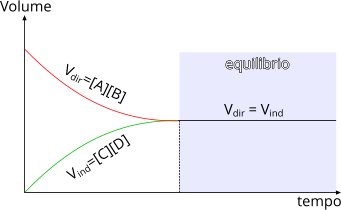
Reazione all'equilibrio, analisi grafica della concentrazione dei prodotti e dei reagenti
La reazione chimica, nonostante sia all'equilibrio, non è statica poiché si formano continuamente nuove molecole di prodotto e, altrettanto continuamente, tornano a formarsi nuove molecole di reagente. Per questa ragione, si definisce questo stato attraverso l'espressione: equilibrio dinamico.
Costante di equilibrio
La costante di equilibrio (Kc o semplicemente K) è un valore, costante per le specie, coinvolte in una reazione all'equilibrio. La definizione di costante equilibrio chimico è data dalla legge di azione di massa:
In una reazione che ha raggiunto l'equilibrio, il rapporto tra il prodotto delle concentrazioni dei prodotti e quello dei reagenti, elevato al proprio coefficiente stechiometrico risulta essere una costante
In una generica reazione reversibile
$$aA + bB \rightleftharpoons cC + dD$$
la costante dell'equilibrio è cosi calcolata:
$$K_{c} = \frac{[C]^{c}\cdot[D]^{d}}{[A]^{a}\cdot[B]^{b}}$$
Costante di equilibrio per i gas
La Kc è utile per il calcolo della costante di equilibrio qualora prodotti e reagenti siano allo stato solido. Per le sostanze aeriformi, invece, è consigliato valutare la costante in termini di pressione parziale di ciascun elemento. La Kp è così calcolata:
$$K_{p} = \frac{(P_{C})^{c}\cdot(P_{D})^{d}}{(P_{A})^{a}\cdot(P_{B})^{b}}$$
Per le reazioni tra gas la pressione all'equilibrio deve rimanere costante.
Equilibrio spostato a destra o sinistra
Osservando i valori della costante di equilibrio è possibile, utilizzando una espressione di utilizzo comune, comprendere se l'equilibrio è spostato a destra (verso i prodotti) o se è spostato a sinistra (verso i reagenti). Quando la costante di equilibrio supera il valore di 1 si definisce equilibrio spostato a destra e si raggiunge quando la concentrazione dei prodotti supera la concentrazione dei reagenti. Viceversa, quando la costante assume un valore minore di uno, allora l'equilibrio è spostato a sinistra ed indica che la concentrazione dei reagenti è superiore rispetto alla concentrazione dei prodotti.
Il principio di Le Chatelier.
In una reazione all'equilibrio, per svariate ragioni, può rendersi necessario introdurre o sottrarre prodotti o reagenti. La sintesi dei prodotti (reazione diretta) e dei reagenti (reazione indiretta), in questo caso varia in base alla specie coinvolta. Il principio di le Chatelier afferma che un sistema all'equilibrio reagisce sempre spostando l'equilibrio verso "destra", dunque verso la formazione dei reagenti, o verso "sinistra", verso la formazione dei prodotti se, rispettivamente, sono aggiunti equivalenti di reagenti o di prodotti. Qualora prodotti o reagenti venissero sottratti vale l'affermazione opposta.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?