La struttura di Lewis è una struttura atomica e molecolare, proposta dal chimico statunitense Gilbert Lewis, attraverso la quale è possibile porre una particolare attenzione al numero di elettroni dello strato esterno del guscio elettronico. Gli elettroni esterni sono, infatti, definiti elettroni di valenza.
La rappresentazione di un atomo, attraverso la struttura di Lewis, è direttamente collegata alla configurazione elettronica dell'atomo stesso; questo accade poiché gli elettroni di valenza sono quelli presenti negli orbitali più esterni o, in altre parole, quelli relativi al numero quantico principale, che tra i numeri quantici possiede maggiore energia. La struttura di Lewis è anche conosciuta come struttura a puntini per via della sua particolare veste grafica.
L'idrogeno, ad esempio, possiede configurazione 1s1 ed ha un solo elettrone di valenza. Il neon, un gas nobile, ha configurazione elettronica 1s22s22p6 e, nell'orbitale N=2, possiede ben otto elettroni: 2s2 e 2p6.
Costruzione della struttura di Lewis di un atomo
Gli elettroni singoli, o spaiati, sono raffigurati attraverso l'utilizzo un puntino. Il doppietto elettronico può essere raffigurato sia mediante due puntini sia mediante un trattino. Gli elettroni sono disposti lungo i quattro lati di un quadrato ideale che circola la sigla dell'elemento, ad uno ad uno ed in senso orario. Per ogni lato è ammessa la presenza di soltanto due elettroni; in altre parole un atomo illustrato attraverso la struttura di Lewis può riportare, al massimo, otto elettroni di valenza (due per ciascuno dei quattro lati).
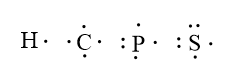
Struttura di Lewis di idrogeno,
carbonio, fosforo e zolfo.
Struttura di Lewis in specie isoelettroniche
Una molecola o uno ione, si definisce isoelettronica, quando possiede una medesima struttura di Lewis e, allo stesso tempo, possiede uno stesso numero di elettroni di valenza. Ad esempio, lo ione cianuro (CN-) e il monossido di carbonio (CO) sono specie isoelettroniche poiché possiedono 10 elettroni di valenza e la medesima struttura di Lewis.
Struttura di Lewis e legame chimico
Il legame chimico tra due o più atomi dipende dalla presenza degli elettroni nel guscio esterno. In linea generale, la struttura di Lewis permette di stabilire la possibilità di legame tra due o più atomi. Ad esempio, il carbonio possiede quattro elettroni spaiati all'esterno e può formare quattro legami con elementi con un elettrone spaiato, mediante la formazione di un legame covalente. Il metano, la cui struttura è CH4, è un esempio di legame di quattro idrogeni con un singolo atomo di carbonio.
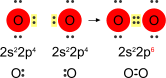
Formazione di un legame covalente e rappresentazione attraverso la struttura di Lewis.
Carica formale
Utilizzando una struttura di Lewis è facile assegnare una carica formale alle molecole e agli ioni. Una carica formale, infatti, non è che una carica assegnata al singolo atomo calcolata in base alla posizione dello stesso, ed ai legami che pone in essere, all'interno della struttura di Lewis.
La carica formale è definita attraverso l'equazione sottostante.
Carica formale = Numero elettroni di valenza - [Numero di elettroni di coppie solitarie + 0.5(Elettroni di legame)]
La somma delle cariche formali su una molecola, o la carica formale dello ione, deve essere uguale alla carica netta della molecola o dello ione.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?