La regola dell'ottetto è una osservazione empirica, enunciata dal chimico inglese G. Lewis, che illustra la proprietà di alcuni atomi di tendere verso una configurazione elettronica stabile nella quale, gli elettroni esterni raggiungono la configurazione elettronica s2p6.
Il numero totale di elettroni esterno è pari a otto e, per questa ragione, la regola porta tale nome. Un ottetto elettronico è, in altre parole, una condizione nella quale un atomo forma un legame chimico con un'altra entità chimica per raggiungere la configurazione elettronica del gas nobile che lo segue o lo precede.
Gli atomi, per raggiungere la conformazione stabile dell'ottetto, cedono, acquistano oppure mettono in compartecipazione gli elettroni di valenza del guscio elettronico.
Per alcuni atomi a basso numero atomico, la regola dell'ottetto non può essere applicata poiché il numero di elettroni è sempre uguale, in una specie neutra, al numero di protoni presenti nel nucleo atomico. Per questa ragione, alcuni elementi tendono a essere maggiormente stabili con due soli elettroni nel guscio di valenza. L'idrogeno molecolare, ad esempio, anziché un ottetto possiede un duetto elettronico.
Esempio di regola dell'ottetto: ossigeno molecolare
L'ossigeno possiede sei elettroni di valenza, giacché la sua configurazione elettronica è s2p4. Per raggiungere l'ottetto stabile (s2p6) necessita di ottenere un doppietto elettronico. L'unione di due atomi di ossigeno permette la condivisione di una coppia di elettroni e rende possibile il raggiungimento dell'ottetto.
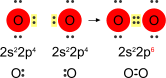
Formazione di un legame covalente in accordo alla regola dell'ottetto.
Eccezioni alla regola dell'ottetto
La maggior parte delle molecole e degli ioni sembrano obbedire alla regola dell'ottetto sebbene alcuni composti rappresentino delle eccezioni. Ci sono, infatti, alcune particolarità atomiche o - in genere - molecolari che non permettono la formazione di un ottetto che derivano esclusivamente dal numero di elettroni presenti nella molecola.
- Molecole con atomi che possiedono meno di otto elettroni di valenza, ad esempio il trifluoruro di boro.
- Molecole con atomi che possiedono più di otto elettroni di valenza, ad esempio il trifluoruro di cloro.
- Molecole con un numero dispari di elettroni, ad esempio i radicali liberi.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?