L'elettrone è una particella subatomica che fa parte dell'atomo. Ha carica negativa, ed è bilanciato - all'interno dell'atomo - dalla carica positiva del protone.
Gli elettroni sono disposti attorno all'atomo nel cosiddetto guscio elettronico, a livello del quale si disponongono, secondo la teoria più accreditata, in più orbitali atomici.
La maggior parte delle caratteristiche fisiche e chimiche dell'atomo derivano proprio dalla presenza degli elettroni. Ad esempio, è grazie agli elettroni che gli atomi possono legarsi tra loro, formando molecole più o meno complesse.
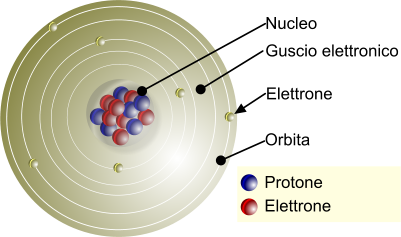
Struttura semplificata dell'atomo. Gli elettroni sono disposti lungo il cosiddetto guscio esterno.
Classificazione degli elettroni
Sebbene gli elettroni facciano parte dell'atomo, è opportuno classificarli in base al loro ruolo nella formazione di un legame chimico e, in generale tenendo conto del loro contributo nella genesi delle proprietà atomiche.
Gli elettroni più interni sono definiti elettroni di core e non hanno un ruolo attivo né sulla formazione del legame né sulle proprietà dell'atomo. Gli elettroni esterni, quelli cioè più distanti dal nucleo, invece, conferiscono le proprietà tipiche dell'atomo poiché, grazie ad essi, è possibile la formazione del legame chimico. In linea generale, gli elettroni di valenza - limitatamente agli elementi di transizione - sono definiti, nella configurazione elettronica, negli orbitali ns e (n-1)d.
Scoperta degli elettroni
L'ipotesi relativa alla presenza di un corpuscolo affonda le proprie radici nel XIX secolo quando William Crookes, utilizzando un tubo di Geissler, osservò che nel tubo a pressione minima, al variare dei gas e della corrente continua ad esso applicata, variava l'intensità e l'emissione di luce. Era plausibile che almeno una particella fosse responsabile di questo fenomeno.
Durante gli anni successivi, numerosi fisici e chimici lavorarono sul tubo di Geissler, dimostrando che il flusso di queste particelle procedeva dal catodo verso l'anodo e che lo stesso flusso era deviato da un campo magnetico applicato nel sistema. Questa osservazione lasciava presupporre che la carica di questa particella potesse essere negativa.
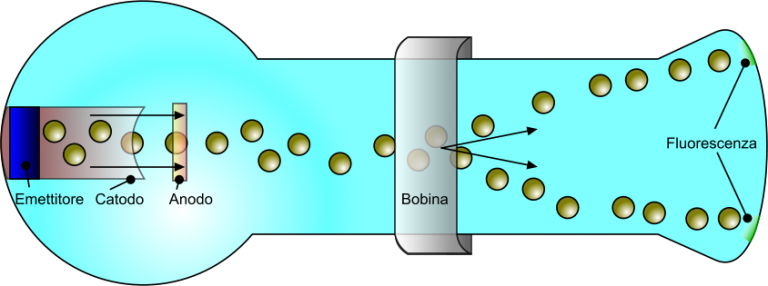
In un tubo catodico, gli elettroni emessi da un emettitore o riscaldatore sono deviati da una bobina, in tensione, e rilevati dallo schermo a fluorescenza.
Un grosso passo per la definizione dell'elettrone fu compiuto da Joseph Thomson che riuscì a stimare la massa e la dimensione dei corpuscoli che, subito dopo, vennero chiamati elettroni.
Successivamente, molte osservazioni e analisi furono veicolate sugli appena scoperti elettroni. Ad esempio, furono definite con un buon margine di definizione sia la carica sia la massa e, osservazione molto importante, si comprese che gli elettroni non ruotano attorno al nucleo seguendo una semplice orbita circolare.
Anche se, attualmente, è comunemente accettata la definizione secondo la quale un elettrone ruoti attorno al nucleo, con l'avvento della meccanica quantistica, il lavoro di Bohr fu messo in forte discussione poiché era perfettamente abbinabile agli atomi di idrogeno (o agli anioni monoelettronici) ma forniva risultati fuorvianti qualora fosse applicata ad atomi polielettronici.
Meccanica quantistica degli elettroni
La scoperte relative alle proprietà dell'atomo e dei suoi costituenti iniziarono ad essere in forte contrasto con le leggi della fisica "classiche". L'elettrone, se considerato come una semplice particella carica elettricamente, deve obbedire alla meccanica classica e, allo stesso tempo, obbedire alle stesse leggi delle strutture macroscopiche. In realtà, gli elettroni e le altre particelle sub-atomiche, non possiedono comportamenti aderenti alla meccanica classica. Inoltre, il modello di Bohr non trovava alcun riscontro negli atomi con due o più elettroni.
Il modello di Bohr ebbe, senza dubbio alcuno, il privilegio di aver aperto la strada ad una teorizzazione atomica scientifica e sperimentale ma la sua applicazione era efficace limitatamente all'idrogeno, o comunque agli ioni con singolo elettrone. Per questa ragione, fu sperimentalmente elaborata un tipo di meccanica che meglio spiegava le leggi relative al mondo atomico, che prese il nome di meccanica quantistica.
Il concetto stesso di orbita degli elettroni, per quanto didattico potesse essere, fu messo in discussione quando si scoprì che l'elettrone ha caratteristica sia corpuscolare che di onda elettromagnetica, buona parte di questo lavoro fu compiuto dal fisico De Broglie nel 1924. Questa scoperta fu importante per comprendere la cosiddetta quantizzazione dell'energia degli elettroni.
De Broglie propose una equazione, che prese il suo nome, secondo la quale:
λ = h / mv
Dove:
λ = Lunghezza d'onda;
h = Costante di Planck;
m = Massa dell'elettrone;
v = Velocità dell'elettrone;
L'elettrone, all'interno dell'atomo, assume una caratteristica di onda, e non è esclusivamente legato alla sua natura corpuscolare. Per questa ragione, a differenza di un ipotetico moto planetario (ad esempio di uno dei pianeti del sistema solare), non segue un'orbita ma un orbitale.
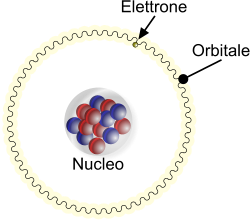
Percorso quantizzato dell'elettrone nell'orbitale.
Il moto dell'elettrone, se analizzato con la nuova prospettiva quantistica, risulta essere limitato a una parte di spazio esattamente come la corda di una chitarra è fissata su due punti dello strumento. Pizzicando la corda si produce una vibrazione. Allo stesso modo l'elettrone vibra all'interno dell'orbitale, secondo lunghezze d'onda definite e precise. In altre parole, la lunghezza d'onda può assumere soltanto determinati valori e, questi valori, sono associati all'energia dell'orbitale.
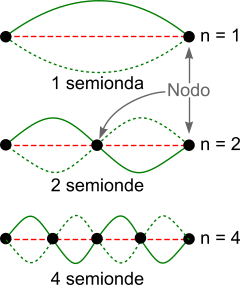
L'elettrone è vincolato al moto secondo un'onda stazionaria che, in base ai nodi, presenta sempre un numero intero di semionde.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?