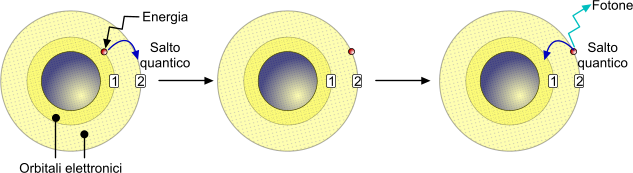
Il salto quantico, in chimica nucleare, è un fenomeno di promozione o di retrocessione di un elettrone da un orbitale atomico verso un altro orbitale a maggiore energia (nel caso dellla promozione) o minore energia (nel caso della retrocessione).
La presenza di un elettrone all'interno di uno specifico orbitale è regolata dalla cosiddetta quantizzazione dell'energia. In altre parole, l'elettrone è presente in un orbitale esclusivamente in base al quantitativo di energia ad esso associato. Fornire energia ad un elettrone permette il cosiddetto "Quantup leap", attraverso il quale l'elettrone è promosso a un orbitale con livello energetico superiore. L'elettrone permane per un periodo di tempo variabile nello stato "promosso" e, successivamente, ritorna nel suo stato iniziale restituendo energia sotto forma di un fotone.
Il fotone assume una lunghezza d'onda esattamente uguale alla differenza tra l'energia finale e l'energia iniziale.
Salto quantico.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?