Una reazione chimica è un evento di trasformazione che coinvolge entità particellari (elementi, atomi, ioni o molecola), all'interno di un sistema che, in chimica, è spesso definito con il termine di reattore. In una reazione completa si distinguono almeno due soggetti: i reagenti e i prodotti (o prodotti di reazione) che derivano dalla reazione dei reagenti.
Le trasformazioni chimiche e - in genere - le reazioni chimiche possiedono una valenza sia biologica sia economica. Qualsiasi organismo, ad esempio, pone in essere in modo continuativo le reazioni chimiche che sono riconosciuto, globalmente, con il nome di metabolismo. Dal punto di vista commerciale e industriale, le reazioni chimiche sono utilizzate per la produzione o la raffinazione delle materie prime nel settore primario e secondario.
La produzione dei principi attivi, utilizzata nel farmaci, avviene grazie alla sintesi chimica che fa uso di determinate reazioni per la sintesi del prodotto finale.
Convenzione grafica
Affinché qualsiasi reazione possa essere facilmente e globalmente compresa, si utilizzano delle convenzioni grafiche internazionali. Ad esempio, i reagenti di una reazione sono messi a sinistra, mentre i prodotti a destra. Inoltre una freccia stabilisce il tipo di reazione: se la freccia è orientata verso destra si definisce una reazione irreversibile, altrimenti se vi sono due frecce antiparallele la reazione è reversibile che è indice di un equilibrio chimico.
Convenzione grafica per alcuni tipi di reazione
| Tipo di reazione |
Rappresentazione grafica |
|---|
| Reazione irreversibile |
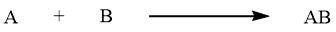 |
| Reazione irreversibile con coefficienti stechiometrici |
 |
| Reazione irreversibile con reagente che fuoriesce dal sistema |
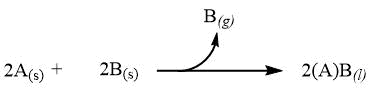 |
| Reazione irreversibile con catalizzatore |
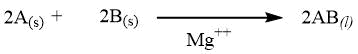 |
| Reazione all'equilibrio |
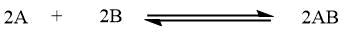 |
| Reazione all'equilibrio con informazioni sullo stato della materia di reagenti e prodotti (g = aeriforme, l = liquido, s = solido) |
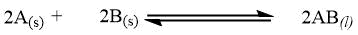 |
Conservazione della massa
Qualsiasi reazione obbedisce alla legge di conservazione della massa, secondo la quale la massa dei reagenti è sempre uguale alle masse dei prodotti. In altre parole, le particelle coinvolte in qualsiasi reazione chimica non si creano, né si distruggono, ma semplciemente si trasformano in altre particelle.
In alcune reazioni chimiche, la materia è, apparentemente, dissolta poiché non è più, visivamente, apprezzabile. In realtà, la materia ha semplicemente subito una trasformazione, sia qualitativa (ad esempio attraverso la formazione di prodotti di reazione diversi dai reagenti) sia quantitativa poiché parte dei reagenti è servita per produzione di parte dei prodotti. In altri casi, varia lo stato della materia, ad esempio una reazione chimica di combustione di un albero sembra che consumi il tronco e lo faccia sparire; in realtà, il carbonio largamente presente nellla lignina del tronco subisce una trasformazione ed e diventa in parte cenere, e in larga parte anidride carbonica.
Bilanciamento della reazione chimica
Il bilanciamento dell'equazione chimica, o semplicemente, bilanciamento è la procedura attraverso la quale le masse dei prodotti e le masse dei reagenti, attraverso l'utilizzo del coefficiente stechiometrico, ove necessario, risultano bilanciate.
Ad esempio, in soluzione acquosa l'acido cloridrico (HCl) si dissocia totalmente nei suoi rispettivi ioni e la reazione non necessita di essere bilanciata:
$$HCl\underset{H_{2}O}{\rightarrow}H^{+} + Cl^{-}$$
In altre reazioni, tuttavia, il numero di atomi deve essere bilanciato affinché le rispettive masse rimangano uguali tra reagenti e prodotti. Ad esempio, nella sintesi del diossido di cloro (ClO2) i prodotti e i reagenti coinvolti sono i seguenti:
$$\underset{Ipoclorito\ di\ sodio}{NaClO_{2}} + \underset{Cloro}{Cl_{2}} \rightarrow ClO_{2} + NaCl$$
Il numero di massa non è bilanciato e, per questa ragione, è necessario calcolare i coefficienti stechiometrici.
$$\underset{Ipoclorito\ di\ sodio}{2NaClO_{2}} + \underset{Cloro}{Cl_{2}} \rightarrow 2ClO_{2} + 2NaCl$$
Energia di attivazione
Un importante parametro da tenere in considerazione nell'analisi della cinetica di qualsiasi reazione è l'energia di attivazione. Affinché due reagenti possano interagire tra loro è importante che vi sia un minimo di energia interna affinché possa avvenire un urto produttivo tra i reagenti. Secondo questo concetto, quando un sistema possiede sufficiente energia interna la possibilità che due reagenti si scontrino è molto alta; questa considerazione è riportata poiché l'energia cinetica delle molecole è sufficientemente alta da aumentare la possibilità di uno "scontro casuale". Quando l'energia interna è molto bassa, invece, il completamento della reazione non è favorito proprio perché diminuisce sensibilmente la possibilità di un urto produttivo.
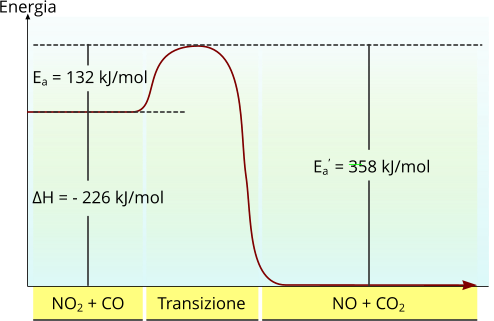
In una reazione chimica, l'energia di attivazione è un parametro che, direttamente, modula la velocità di reazione. Il massimo livello di energia coincide con il cosiddetto stato di transizione.
Effetto della temperatura sulla velocità di reazione
La velocità di reazione è direttamente modulata dalla temperatura del sistema. Nell'industria chimica, la temperatura è sempre controllata e, per ciascuna reazione, è mantenuta entro un limite molto stretto. A volte, è necessario rimanere entro range di pochi gradi celsius affinché la resa di produzione, e anche la sicurezza, sia accettabile. Ad esempio, nei reattori le temperature sono mantenute alte qualora si necessiti di reazioni ad esecuzioni veloci, mentre - in altri ambiti - la temperatura è volontariamente mantenuta bassa per evitare che la reazione possa assumere carattere esplosivo o, comunque, pericoloso.
Questo concetto, sebbene riguardi la natura quantistica dell'atomo è anche applicato nelle centrali termonucleari dove la temperatura di sistema è controllata attraverso il raffreddamento con acqua pesante per evitare esplosioni del nocciolo di reazione.
Effetto dell'orientamento molecolare sulla reazione
Affinché una reazione possa compiersi, con una accettabile velocità, spesso non è sufficiente che il valore di energia interna sia pienamente soddisfatto, ma è anche necessario che le molecole siano orientate in un modo tale da far diventare l'urto di tipo produttivo. La maggiore energia cinetica, posseduta dai reagenti, ovviamente rende possibile una maggiore casualità tra gli urti ma, in alcuni casi, degli eventi esterni possono modificare le condizioni a tal punto da compromettere l'efficacia della reazione. Ad esempio, in una reazione organica o biologica, dove a reagire non sono semplici ioni o elementi, è possibile che la conformazione tridimensionale della molecola subisca un tale effetto che rende impossibile la reazione con altre molecole.
Energia di attivazione, catalizzatore ed enzima
L'energia di attivazione può essere modulata quando, nel sistema, è introdotto un catalizzatore. I catalizzatori si distinguono in catalizzatori inorganici, ad esempio il magnesio, oppure enzimi, che sono catalizzatori biologici. In una reazione catalizzata, il catalizzatore abbassa l'energia di attivazione in modo estremamente rapido ed efficiente, rendendo la reazione chimica possibile anche con un sistema a bassa energia.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?