Il legame peptidico è un tipo di legame chimico che si instaura tra due aminoacidi. Un piccolo numero di aminoacidi legati tra loro attraverso un legame peptidico è definito peptide. Quando gli aminoacidi legati sono numerosi si forma una struttura complessa chiamata proteine.
È un tipo di legame molto importante per la biologia degli esseri viventi poiché garantisce allo stesso tempo la rigidità necessaria a uno scheletro proteico, fatto dunque di una lunga sequenza di aminoacidi e, allo stesso tempo, una buona capacità di torsione lungo l'asse tra carbonio e azoto.
Formazione del legame peptidico
Come si forma un legame peptidico?_==
Gli aminoacidi possiedono un gruppo carbossilico (-COOH) e un gruppo aminico (-NH3). I due gruppi funzionali sono legati, generalmente, al carbonio α. Tra questi due gruppi avviene una reazione di condensazione che porta alla formazione del legame tra azoto e carbonio dei due, differenti, aminoacidi.
Il legame peptidico tra due aminoacidi, ad esempio glicina e serina, è illustrato in questo esempio:
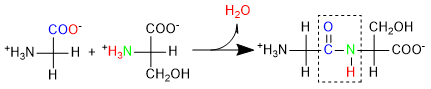
Formazione del legame peptidico. Gli atomi sono colorati per maggiore chiarezza.
Caratteristiche del legame peptidico
La presenza di un legame tra carbonio e azoto, rende il legame peptidico molto particolare sia dal punto di vista chimico sia dal punto di vista funzionale.
Legame trans e cis
==_Quali sono le differenze tra un legame peptidico in cis e uno in trans?_==
Nel legame peptidico l'ossigeno carbonilico (C=O) e l'idrogeno legato all'azoto sono, generalmente, in conformazione trans. In altre parole, i due atomi sono, spazialmente, disposti su piani separati. La raffigurazione grafica di un legame peptidico sia in trans sia in cis è sotto riportata.
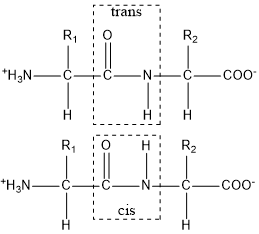
Legame peptidico. Sopra, in conformazione cis, sotto in conformazione trans.
La conformazione in trans è maggiormente presente in natura. Il tipo di legame (trans o cis) non è casuale perché dipende dall'ingombro sterico delle catene laterali. La conformazione cis in un generico peptide può essere ottenuta se le catene laterali non offrono un marcato ingombro sterico.
Rigidità del legame peptidico
Il legame peptidico possiede una peculiarità che riguarda la libera rotazione lungo l'asse C-N. Prendendo in considerazione soltanto il legame è possibile notare che l'ossigeno, molto elettronegativo, attira verso di sé gli elettroni coinvolti nel legame, riarrangiando la molecola in due forme che si stabilizzano a vicenda. In questo modo è impedita la libera rotazione lungo l'asse -C-N in virtù della presenza di uno pseudo-doppio legame che, seppur non persistente, non permette la rotazione dei due gruppi.
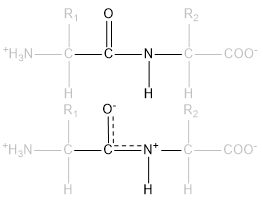
Delocalizzazione e "risonanza" degli elettroni, e rigidità del legame peptidico.
==_Qual è la lunghezza del legame peptidico?_==
La lunghezza del legame peptidico è di 0.132nm.
Momento di dipolo
==_Cos'è e qual è la definizione di momento di dipolo
Il legame peptidico presenta un momento di dipolo, poiché gli atomi di ossigeno e azoto sono più elettronegativi dei rispettivi atomi di carbonio e idrogeno.
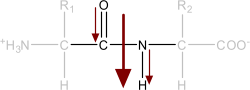
Momento di dipolo tra ossigeno-carbonio, azoto-idrogeno e momento di dipolo totale in un legame peptidico.
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?