Il collagene è una proteina fibrosa, presente negli animali in gran quantità. È la proteina caratterizzante il tessuto connettivo. Offre un supporto di natura meccanico ala cellula e, per questa ragione, può essere considerata come una proteina "isolante".
Struttura
Il collagene è formato da una tripla elica ricchissima in prolina, che conferisce un particolare motivo strutturale. Dal punto di vista strutturale, il collagene è l'unione di differenti strutture lineari, con altrettanto differenti tipi di composizione per quanto riguarda gli aminoacidi. L’unità funzionale del collagene è il tropocollagene, una molecola formata da tre filamenti sinistrorsi che, unendosi tra loro formano una singola elica destrorsa.
Il tropocollagene è formato da motivi ripetuti che, in genere, seguono lo schema glicina-prolina/idrossiprolina-lisina/idrossilisina.
Stabilità
La stabilità del collagene è direttamente collegata alla struttura terziaria e alle complesse interazioni molecolari tra le catene. I legami ad idrogeno tra la glicina e gli altri aminoacidi, definiti in termini generici come legami intercatena, stabilizzano la tripla elica giacché sono presenti in gran numero. Per questa ragione, quando la glicina, ad esempio a causa di patologie, non è presente si verifica un indebolimento del collagene che, di fatto, perde la sua funzionalità.
Fibre di collagene
Dal tropocollagene si formano, per associazione, differenti tipi di fibre. Il tropocollagene, è una struttura uniforme, dalla lunghezza e dalle proprietà chimiche relativamente invarianti; tuttavia le fibre di collagene, anche in rapporto al tipo di tessuto di collocazione, mostrano delle differenti caratteristiche. Alcune fibre, ad esempio, possiedono una andatura regolare, con strati di tropocollagene apposti in modo lineare e sequenziale, mentre altre fibre assumono una morfologia e una struttura casuale.
Biosintesi del collagene
La biosintesi del collagene è un evento enzimaticamente coadiuvato. L'mRNA di diversi geni è dapprima trascritto e successivamente tradotto a livello dei ribosomi. La formazione del collagene è un evento molto complesso, poiché coinvolge differenti organuli cellulari.
A seguito della traduzione, mediante due specifici enzimi alcuni residui di prolina vengono idrossilati, per formare idrossiprolina e idrossilisina. A livello dell'Apparato del Golgi i filamenti idrossilati subiscono una glicosilazione a livello dell'idrossilisina. Nel successivo passaggio si formano i ponti disolfuro con una, conseguente, formazione della tripla elica; in questo passaggio la struttura è chiamata - genericamente - procollagene. Per la formazione del collagene propriamente detto, il procollagene è secreto nello spazio della matrice e ivi processato.
Idrossilazione della prolina e della lisina
L'enzima prolina idrossilasi catalizza la biosintesi di idrossiprolina a partire dalla prolina. L'enzima necessita di numerosi cofattori, tra cui l'ossigeno molecolare (O2) e la vitamina C o acido ascorbico; è stato sperimentalmente verificato che bassi livelli di acido ascorbico influenzano negativamente la biosintesi del collagene.
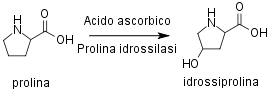
Biosintesi dell'idrossiprolina.
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?