Nome: *NA*
Nome alternativo:*NA*
EC:*NA*
Classe: {{{classe}}}
Il
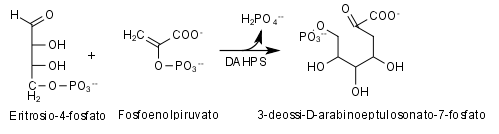
DAHPS o
3-deossi-7-fosfoeptulonato sintasi è un enzima appartenente alla classe delle transferasi che catalizza una importante reazione di condensazione a livello della
via dello shikimato. L'enzima è presente nei batteri, a livello dei quali rappresenta un punto di controllo, per la biosintesi del
corismato che è l'intermedio comune per molti metaboliti, tra cui gli
aminoacidi triptofano,
fenilalanina e
tirosina, ed altre molecole tra cui l'acido p-aminobenzoico. Nelle piante, seppur con una differente conformazione, l'enzima catalizza la formazione dei medesimi metaboliti ed ha, anche nel contesto eucariotico, un ruolo di controllo della via dello shikimato. Tuttavia, nei batteri la maggior parte degli aminoacidi elencati serve per la
sintesi proteica, mentre nelle piante la via dello shikimato serve per la biosintesi dei cosiddetti
metaboliti secondari.
L'enzima DAHPS richiede un catione bivalente come cofattore; in base all'isoforma, l'enzima utilizza un catione magnesio o ferro.
Via dello shikimato e DAHPS
Struttura dell'enzima
Esistono numerose isoforme e isoenzimi del DAHPS presenti a livello dei batteri e delle piante. Nelle piante, ad esempio, due differenti geni vengono espressi a seguito di due stimoli differenti: attacco di patogeni e ferite. La dislocazione degli isozimi nei differenti organi è, inoltre, differente.
DAHPS dei batteri
Il DAHP sintasi dei batteri è stato purificato e analizzato in Escherichia coli dove sono stai purificati tre isoenzimi di struttura oligomerica. I tre isoenzimi sono sensibili agli aminoacidi fenilalanina, tirosina e triptofano. La presenza di uno dei tre aminoacidi appena elencati inattiva il corrispettivo isozima sensibile; si è, tuttavia, osservato che l'aumento di concentrazione di un aminoacido, ad esempio della fenilalanina, non influenza l'attività degli enzimi sensibili agli altri aminoacidi, ad esempio tirosina o triptofano, dunque ogni isoforma è sensibile soltanto a uno specifico aminoacido.
I tre enzimi rispondono ad un meccanismo di regolazione mediante l'inibizione da feedback ma, in relazione alle quantità degli aminoacidi, non rispondono allo stesso modo. Ad esempio, le varianti sensibili alla fenilalanina e alla tirosina, risultano quasi sempre inibite poiché piccolissime quantità degli aminoacidi riescono a disattivare gli enzimi.
DAHPS nelle piante
Nelle piante esistono due differenti isoforme dell'enzima DAHPS, dipendenti rispettivamente dai cationi magnesio e cobalto. Le varianti Mg-dipendenti sono, generalmente, presenti nel lume del mitocondrio, mentre le varianti Co-dipenendti sono localizzabili nel citoplasma. La variante Mg-dipendente, inoltre, sembra essere ulteriormente presente in due isozimi, interpretabile come una comune discendenza ancestrale seguita da una duplicazione casuale di un antenato comune.
Nonostante la presenza di un probabile antenato comune, la differenza strutturale tra DAHPS nei batteri e nelle piante è sostanziale. La DAHPS eucariotica, infatti, è più pesante e possiede circa 100 residui aminoacidici in più rispetto alla forma batterica.
Regolazione dell'attività del DAHPS nelle piante
L'attività dell'enzima DAHPS eucariotico è stata sperimentalmente analizzata e ha permesso di osservare un comportamento inaspettato della proteina. La maggior parte degli enzimi subiscono una inibizione da prodotto, in altre parole un enzima che sintetizza una generica molecola è inibito, o comunque fortemente rallentato, da una elevata concentrazione della molecola. Il DAHPS, presente a livello delle piante, sembra essere attivato, anziché disattivato, dalla presenza del triptofano e della tirosina.
Nella seconda metà del XX secolo fu proposto un modello secondo il quale l'arogenato, un precursore della fenilalanina e della tirosina, potesse essere un inibitore dell'attività del DAHPS. Studi più approfonditi hanno permesso di stabilire che l'enzima DAHPS è indotto dagli stati di stress, ad esempio a seguito di una ferita del fusto o di un altro organo della pianta, che determinano una maggiore produzione di lignina oppure da variazioni nell'assorbimento della radiazione luminosa.
Riepilogo delle classi enzimatiche
| Numero + Classe |
Descrizione |
Esempi |
| 1. Ossidoreduttasi |
Operano reazioni di ossidoriduzione. |
Alcol deidrogenasi |
| 2. Transferasi |
Operano reazioni di trasferimento di atomi o gruppi. |
Esochinasi, Chinasi |
| 3. Idrolasi |
Operano idrolisi sul substrato. |
|
| 4. Liasi |
Operano addizioni mediante doppi legami. |
|
| 5. Isomerasi |
Operano reazioni di isomerizzazione |
|
| 6. Ligasi |
Operano reazioni che portano alla formazione di legami. |
|
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?