L'alfa-elica è un tipo di struttura secondaria presente in alcune proteine. Le proteine che presentano un motivo ad alfa elica sono, strutturalmente, simili a una spirale; in questa formazione le catene laterali degli aminoacidi sono disposte verso l'esterno e le teste sono rivolte verso l'interno. La presenza di differenti tipi di catene laterali può rendere una alfa-elica idrofobica oppure idrofilica.
Un giro completo dell'elica, altrimenti definito come passo, coinvolge circa quattro aminoacidi i quali, tra loro, possono interagire mediante i legami a idrogeno.
Struttura stabile dell'alfa elica
La presenza del legame peptidico e la comparsa di legami a idrogeno tra le catene laterali degli aminoacidi rendono l'alfa elica una struttura molto stabile e resistente.
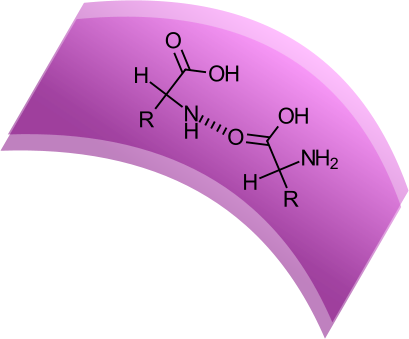
Legame ad idrogeno tra due aminoacidi in una alfa-elica.
I legami peptidici a livello dell'alfa elica sono di tipo trans; per ogni passo sono presenti circa 36 aminoacidi con andamento a spirale, solitamente, destrorso. Il collagene, tuttavia, presenta una particolarità poiché assume andamento sinistrorso.

Alfa elica sinistrorsa (a sinistra, in verde) e destrorsa (a destra, in rosso).
Biosintesi dell'alfa elica
Al pari degli altri motivi, la struttura secondaria ad alfa-elica deriva direttamente dalla struttura primaria che rappresenta la disposizione lineare degli aminoacidi nella proteina. La presenza di aminoacidi a grande ingombro sterico, come la treonina, l'asparagina e la lisina rende impossibile il ripegamento ad elica. La presenza di questi aminoacidi in quantità elevata genera una struttura secondaria a filamento libero. Anche la prolina, in virtù della sua struttura, rende difficile il ripiegamento ad elica.
Esempi di proteine con motivi ad alfa-elica
La mioglobina è una proteina che presenta un motivo ad alfa elica. Anche la cheratina, nella sua variante di alfa cheratina, ha una sequenza strutturale che forma un'alfa-elica.
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?