Un anticorpo o immunoglobulina è una molecola di natura glicoproteica facente parte del sistema immunitario. Gli anticorpi sono secreti da differenti tipi di cellule del sistema immunitario: i linfociti B e i linfociti T. Gli anticorpi fanno parte della classe delle globuline. Attraverso gli anticorpi, sinteticamente, il sistema immunitario marca e neutralizza molti dei patogeni riconosciuti attraverso sequenze - solitamente proteiche - definite antigeni.
Il ruolo degli anticorpi è duplice e varia in base alla cellula di espressione. Nei linfociti B gli anticorpi sono secreti a seguito del riconoscimento di un patogeno, attraverso il riconoscimento dell'antigene specifico, mentre nelle cellule T gli anticorpi sono espressi come glicoproteine di membrana cellulare e servono a rilevare gli antigeni dei patogeni. I linfociti B, attraverso la secrezione di anticorpi, portano al processo di opsonizzazione attraverso il quale il patogeno è fisicamente circondato da anticorpi e la sua attività biologica è notevolmente rallentata oppure annullata. Nelle cellule T, invece, gli anticorpi sono dei veri e propri sistemi di scansione degli antigeni e servono per la modulazione dell'attività immunitaria.
Struttura degli anticorpi
Gli anticorpi possiedono una struttura relativamente complessa. Sono formati da quattro catene, speculari a loro in coppia. Due catene pesanti e due catene leggere, rispettivamente definite come HC e LC (Heavy Chain e Light Chain) sono uniti da due ponti disolfuro forniti dagli aminoacidi cisteina.
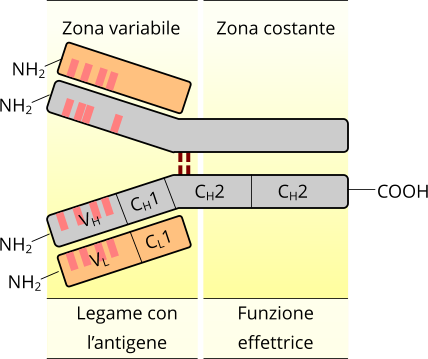
Struttura di un anticorpo sintetizzato da un linfocita B. La zona variabile rappresenta il sito nel quale l'anticorpo è capace di rilevare l'antigene e legarsi ad esso.
In ciascuna delle due catene pesanti si osservano quattro segmenti:
- 3 segmenti CH, o segmento pesanti costanti.
- 1 Segmento VH, o segmento variabile pesante.
Nelle due catene leggere, invece, i segmenti sono due:
- 1 Segmento CL, o segmento costante.
- 1 Segmento VL, o variabile.
Inoltre, esistono due tipi di catene leggere definite lambda (γ) e kappa(κ). La maggiore complessità è espressa nelle regioni che hanno il compito di rilevare l'antigene definite con l'acronico FAB (Fragment Antigen Binding, o frammenti di aggancio dell'antigene).
Classificazione degli anticorpi
Le immunoglobuline sono classificate in cinque superfamiglie: IgG, IgA, IgM, IgD, IgE. La classificazione delle immunoglobuline tiene conto della differnte organizzazione delle catene pesanti; in altre parole le catene pesanti delle immunoglobule G sono strutturalmente differenti dalle restanti quattro superfamiglie.
- IgG. Rappresentano la principale superfamiglia e sono sottoclassificate in IgG1, IgG2, IgG3, IgG4, La sottoclassificazione tiene conto della diversità a livello della catena gamma (γ). Il loro ruolo è molto importante nell'attivazione del sistema del complemento, nel processo di opsonizzazione e coadiuvano l'uccisione cellulare da parte delle cellule NK e dei macrofagi.
- IgA. Presenti in due sottoclassi che si classificano in base alle differenze del ponte disolfuro nella regione cerinera: IgA1 e IgA2. Sono molto attive nel lume delle mucose di molti organi dove sono presenti in forma di monomero.
- IgM. Presenti nella membrana cellulare dei linfociti B, coadiuvano la biosintesi degli altri anticorpi e servono da attivatori per il sistema del complemento.
- IgD. Il loro ruolo sembra essere limitato al riconoscimento degli antigeni a livello delle cellule B in via di maturazione poiché, a livello del siero sanguigno, non è stato ancora riconosciuto alcun ruolo.
- IgE. Praticamente assenti nel siero sanguigno, giocano un ruolo fondamentale nella reazione immediata di ipersensibilizzazione dei mastociti e dei granulociti basofili.
Ruolo biologico
Gli anticorpi sono molecole sintetizzate nei linfociti B ed espresse nei linfociti B e T a livello della membrana cellulare. I linfociti B possiedono un pool incredibilmente numeroso di diversi linfociti agganciati alla membrana cellulare. Una volta captato un antigene, attraverso la zona variabile delle catene pesanti VH o delle catene leggere LC il linfocita B è stimolato a produrre gli stessi anticorpi espressi sulla membrana e a rilasciarli nel sangue; la biosintesi massiva degli anticorpi ha il compito di neutralizzare, attraverso l'opsonizzazione del patogeno e la successiva fagocitosi ad opera dei macrociti.
I linfociti T, invece esprimono soltanto gli anticorpi a livello della membrana cellulare e non neutralizzano attraverso essi la molecola riconosciuta come non-self ma attraverso un sistema di promozione dell'infiammazione e, limitatamente ai linfociti T citotossici (CD8+ O CDL) mediante la liberazione e la proiezione verso la cellula di molecole ad azione citotossica quali i granzimi e la perforina.
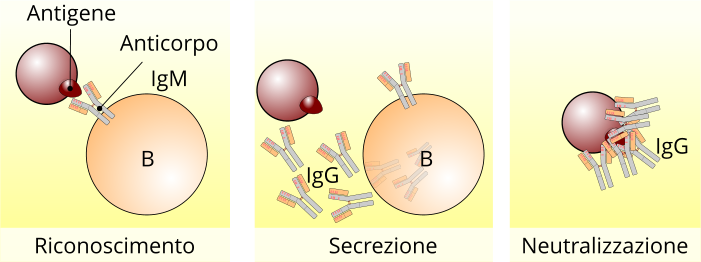
Riconoscimento di un antigene da un linfocita B. Un linfocita B, attraverso il suo anticorpo di membrana che fa parte delle IgM, riconosce un antigene i, in una seconda fase, provvede alla secreazione di anticorpi sierici IgG che, specifici nei confronti del patogeno lo neutralizzano.
Specificità degli anticorpi
Affinché un anticorpo sia funzionalmente e biologicamente valido ed efficace deve possedere una specificità nei confronti del proprio patogeno (non self) e non generare reazioni di riconoscimento nei confronti delle molecole e delle strutture appartenenti all'organismo (self). L'anticorpo deve essere assolutamente specifico per il proprio antigene e non dovrebbe mai dare cross-reazioni con altre strutture altrimenti per evitare una reazione immunitaria nei confronti dell'organismo stesso. La malattia autoimmune rappresenta - genericamente - un tipico caso di riconoscimento errato di una o più strutture dell'organismo da parte del sistema immunitario che, a seguito di questa errata valutazione, inizia una risposta immunitaria distruggendo parte o tutto il tessuto coinvolto.
Ruolo nella ricerca biologica
Gli anticorpi sono utilizzati nella ricerca biologica poiché sono capaci di rilevare un antigene di un tessuto, legarsi ad esso e - successivamente - permettere la visualizzazione da parte dell'operatore del tessuto che ha legato gli anticorpi. Nell'immunoistochimica, ad esempio, speciali anticorpi marcati con fluoresceina o con biotina e specifici per un tessuto sono veicolati contro un campione per validare se lo stesso campione contenga il tessuto di interesse, o parte di esso. In base al tipo di analisi si distinguono:
- anticorpi primari: si legano direttamente al target e possiedono la molecola da rilevare (il cromoforo o la fluoresceina in caso di utilizzo del microscopio a fluorescenza.
- anticorpi secondari: sono marcati e si legano agli anticorpi primari non marcati. Permettono una migliore economicità del test e una maggiore amplificazione del risultato, poiché più anticorpi secondari sono capaci di legarsi a diversi epitopi dell'anticorpo primario.
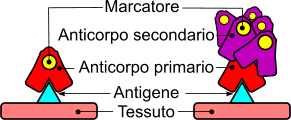
La marcatura secondaria di un antigene, presente nel contesto di un tessuto, offre due vantaggi: il primo, permette l'amplificazione del segnale poiché più anticorpi mancati (secondari) si legano a un singolo anticorpo antige-specifico (non marcato); secondo, il processo di produzione di anticorpi marcati è molto costoso e risulta essere più economico qualora si possano marcare un pool molto grande ed omogeneo di anticorpi secondari specifici per un anticorpo primario.
Gli anticorpi con biotina, o anticorpi biotinilati, sono utilizzati nel metodo avidina biotina.
Origine della variabilità genetica
Le immunoglobuline sono delle proteine ad alta attività immunologica. Hanno il compito di individuare un numero potenzialmente infinito di antigeni e di relativi patogeni e, per questo motivo, devono presentare un numero potenzialmente infinito di immunoglobuline. Validando l'assioma secondo il quale "un gene codifica per una proteina", se il sistema immunitario fosse singolarmente codificato da un singolo gene servirebbero infiniti geni codificanti un altrettanto numero infinito di immunoglobuline. In realtà, il genoma umano, codifica per poche decine di migliaia di proteine, comprese quelle che attraverso la traduzione e la relativa sintesi proteica saranno le future immunoglobuline.
In modo del tutto sorprendente, la variabilità genetica è sotto controllo di pochi geni che, ricombinandosi in modo assolutamente casuale e ripetuto nel tempo, formano proteine non stereotipate ma sempre diverse ciascuna dall'altra. In questo modo, il sistema di differenziamento - a fronte di un ridotto ingombro genico - è capace di fornire un enorme quantitativo di anticorpi, ciascuno diverso dall'altro.
Riepilogo
[$$box
|*Anticorpo*|
|*
Cosa sono gli anticorpi? Gli anticorpi sono molecole del sistema immunitario che proteggono l'organismo attaccando o segnalando potenziali patogeni estranei.
Qual'è la struttura degli anticorpi? Gli anticorpi sono delle immunoglobuline e sono formate da due catene pesanti e due catene leggere.
Quanti anticorpi ci sono nell'organismo umano? Il numero di anticorpi è molto elevato, poiché essi devono riconoscere ciascun patogeno.
*|$$]
Pagine correlate
- Anticorpo monoclonale.
- Anticorpo policlonale.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?