Nome: *NA*
Nome alternativo:*NA*
EC:*NA*
Classe: {{{classe}}}
La lattato deidrogenasi o LDH o lattico deidrogenasi è un enzima presente nel fegato e nel muscolo appartenente alla classe delle ossidoreduttasi. Il ruolo dell'enzima è quello di operare la riduzione dell'lattato in piruvato. L'enzima è NAD-dipendente ed è allostericamente modulato dalla concentrazione di lattato, che opera un feedback negativo. In altre parole, elevati livelli di lattato inibiscono l'azione della LDH.
Reazione
La reazione operata dalla lattato deidrogenasi è di tipo reversibile. L'ossidazione del lattato in piruvato determina un guadagno netto di una molecola di NAD ridotto.
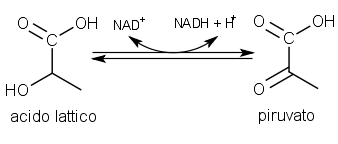
Reazione chimica operata dalla lattato deidrogenasi.
Ciclo di Cori
La lattato deidrogenasi ha un ruolo di fondamentale importanza nel ciclo di Cori, giacché converte il lattato nel fegato (che proviene dal muscolo sotto sforzo) in piruvato, utilizzato nella gluconeogenesi.
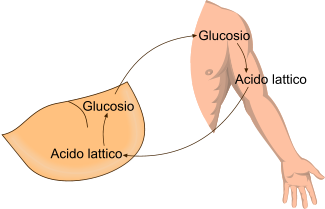
La lattato deidrogenasi è un enzima di fondamentale importanza nel contesto metabolico del ciclo di Cori.
Attraverso questo tipo di metabolismo è possibile, da un lato, allontanare dal muscolo l'acido lattico prodotto durante lo sforzo anaerobio, e dall'altro lato recuperare lo scheletro carbonioso per la produzione di glucosio.
Struttura e isoenzimi
L'LDH umano è formato da due differenti subunità e può essere eteromerico oppure omomerico. La subunità H è maggiormente espressa nel cuore, mentre la subunità L è presente nel fegato. La diversa associazione delle due subunità permette di distinguere cinque diversi isoenzimi. Nei pesci l'enzima è presente con un numero differente d'isoforme.
Localizzazione delle subunità di LDH
| H4 o LDH1 |
H3L1 o LDH2 |
H2L" o LDH3 |
HL3 o LDH4 |
L4 o LDH5 |
|---|
| Cuore |
eritrociti e pancreas |
Polmone o muscolo scheletrico |
Polmone o muscolo scheletrico |
Fegato |
Ogni isoforma possiede delle differenti proprietà chimico-fisiche. Il monomero H4 è termolabile e, durante una elettroforesi termina significativamente in anticipo la corsa rispetto agli altri isoenzimi. Inoltre, la subunità H è maggiormente sensibile alla concentrazione di ossigeno e, per questa ragione, si trova a livello del cuore, a differenza della subunità L che, invece, agisce in condizioni preferenziali di anaerobiosi.
Significato patologico
L'enzima fa parte dei cosiddetti elementi che vengono valutati durante le analisi del sangue. Per misurare il livello della lattato deidrogenasi è sufficiente il prelievo di sangue venoso; è considerato un esame di routine e moderatamente invasivo.
Livelli di lattato deidrogenasi elevati
Un singolo valore di lattato deidrogenasi di qualche percentuale più elevato, di per sé, è poco specifico. Elevati valore di lattato deidrogenasi, tuttavia, possono essere ricondotti a sofferenza del tessuto muscolare. La misura dell'attività della LDH è condotta analizzando l'assorbanza del NADH a 334nm o a 340nm.
In concomitanza con l'analisi di altri elementi, come ad esempio la quantità e la qualità dei globuli rossi o della mioglobina può servire per la diagnosi di malattie più o meno importanti come:
- Infarto cardiaco;
- Anemia;
- Distrofia muscolare;
- Alcuni tumori, specialmente quelli metastatici del fegato.
La presenza di differenti isoforme dell'enzima, rende possibile la localizzazione dell'origine del danno tussutale. La presenza di un isoenzima di tipo H4, ad esempio, suggerisce una alterazione tissutale di origine cardiaca.
Cosa fare in caso di lattato deidrogenasi elevata
L'esame può essere soggetto di alterazioni da parte di numerose variabili. Per questo motivo il primo approccio con la lattato deidrogenasi elevata va sempre verificato con una serie di ulteriori analisi, ripetute nell'arco di una o due settimane.
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Riepilogo delle classi enzimatiche
| Numero + Classe |
Descrizione |
Esempi |
| 1. Ossidoreduttasi |
Operano reazioni di ossidoriduzione. |
Alcol deidrogenasi |
| 2. Transferasi |
Operano reazioni di trasferimento di atomi o gruppi. |
Esochinasi, Chinasi |
| 3. Idrolasi |
Operano idrolisi sul substrato. |
|
| 4. Liasi |
Operano addizioni mediante doppi legami. |
|
| 5. Isomerasi |
Operano reazioni di isomerizzazione |
|
| 6. Ligasi |
Operano reazioni che portano alla formazione di legami. |
|
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?