L'emoglobina, abbreviata in Hb, è una proteina globulare dal peso molecolare di circa 65.000 Dalton presente nei vertebrati all'interno del globulo rosso o eritrocita.
È solubile in acqua ed è presente all'interno dei globuli rossi, che rappresentano una delle varie cellule circolanti all'interno del torrente sanguigno. Attraverso l'emoglobina è trasportato l'ossigeno che, prelevato per scambio gassoso dai polmoni puù dirigersi verso tutti tessuti del corpo, a livello dei quali viene rilasciato. L'ossigeno è indispensabile per la respirazione, ma è poco solubile in acqua; per questa ragione la concentrazione di ossigeno nel sangue è irrilevante e si necessita di un trasportatore adeguato per poterlo veicolare verso i tessuti. L'emoglobina facilita la "cattura" a livello polmonare dell'ossigeno il "rilascio" nei tessuti grazie ad una serie di accorgimenti strutturali. L'affinità dell'emoglobina per l'ossigeno, che dal punto di vista chimico rappresenta un ligando, varia in base alla necessità.
La stessa emoglobina è capace di trasportare una molecola di anidride carbonica (CO2) e protoni (H+).
Struttura dell'emoglobina
Esistono diversi tipi di emoglobina caratteristici di ogni specie. Alcune mutazioni a livello degli aminoacidi possono determinare, anche dentro la stessa specie, più varianti della proteina. Per quanto riguarda l'uomo si distinguono due categorie di emoglobina: quella fetale e quella adulta.
Dal punto di vista strutturale si può dividere l'emoglobina in quattro domini covalentemente legati tra loro. Tali domini vengono chiamati α1, α2, β1 e β2. È di particolare importanza notare la presenza dell'aminoacido istidina, che è presente sia nel segmento E in posizione 7 con il nome di istidina distale sia nel segmento F8 con il nome di istina prossimale.
L'istidina prossimale rappresenta il punto di collegamento tra il gruppo eme ed il residuo proteico dell' emoglobina, mentre l'istidina distale forza l'ossigeno legato ad avere un angolo di legame di circa 120°. Questo fenomeno è di fondamentale importanza, in quanto altre molecole mal sopportano legami con il ferro dell'eme con tale angolazione. In questo modo, si ha una parziale prevenzione del legame del monossido di carbonio, un gas letale per l'organismo, con l'emoglobina. Questo non vuol dire, però, che tale gas non riesce comunque a saturare l'emoglobina, tuttavia in casi di elevata concentrazione di monossido di carbonio l'affinità dell'emoglobina nei confronti del gas è inferiore.
Gruppo eme
La parte fondamentale dell'emoglobina è rappresentata dalla sua porzione prosteica, ovvero non proteica, che prende il nome di eme. È in questa zona che l'ossigeno si lega al ferro ferroso (Fe++) in modo sufficientemente stabile da poter essere trasportato ma allo stesso tempo in modo non covalente per evitare legami stabili con il ferro stesso.
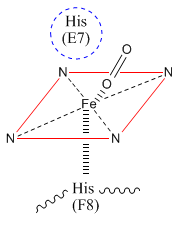
Struttura dell'eme e visualizzazione del ferro ferroso.
L'eme è un complesso formato da quattro anelli pirroloci legati da ponti CH2 ai quali, ulteriormente, sono legati altri elementi chimici. Il ferro è centrale nell'eme, sia come posizione sia come ruolo. Possiede sei legami di coordinazione, quattro dei quali sono impegnati covalentemente con altrettanti atomi di azoto mentre un legame è usato per legare l'ossigeno in modo perpendicolare rispetto al piano dell'eme stesso. Il rimanente legame viene impegnato dall'istidina che, sebbene non si lega covalentemente, stabilizza ulteriormente il gruppo prosteico; un'altra istidina “protegge” l'ossigeno legato al ferro impedendo così di poter reagire ulteriormente con altre molecoli presenti nel sistema. L'aminoacido istidina non è casualmente presente nel sistema, poiché è l'unico compatibile con le condizioni di pH fisiologico grazie al suo punto isoelettrico pari a 7.6
Stato T e stato S dell'emoglobina.
L'emoglobina è una molecola che possiede una determinata affinità per l'ossigeno. In linea generale quando si parla di affinità di una proteina con il suo ligando, ovvero con la molecola che lega, in condizioni di temperatura e pressione costanti si definiscono i termini alta affinità e bassa affinità quando, rispettivamente, la proteina è facilitata nel legame con il proprio ligando o, viceversa, quando incontra difficoltà. L'emoglobina ha ambedue gli stati che si definiscono T, dal termine inglese tight ovvero teso, momento nel quale l'affinità per l'ossigeno è bassa e momento R, ovvero relaxed, che rappresenta il punto nel quale l'affinità per l'ossigeno è massima.
Curva di saturazione dell'emoglobina
Introduzione alla curva di saturazione. L'esempio della mioglobina
Per comprendere il ruolo della curva di saturazione, a livello dell'emoglobina, può essere d'aiuto analizzare la stessa curva in una molecola più "semplice" quale la mioglobina. In linea generale, la mioglobina, è una proteina che lega un ligando, ovvero l'ossigeno, per poterlo trasferire e rilasciare ai tessuti. Questo processo può essere quantitativamente analizzato secondo l'equilibrio:
$$P + L \leftrightarrow PL$$
Dove P raprresenta la proteina, od il sito di legame, ed L il ligando. Questo equilibrio ha una propria costante di associazione Ka. $$K_{a} = \frac{[PL]}{[P]\cdot[L]}$$ Per determinare il rapporto che si instaura tra i siti di legame effettivamente utilizzati e il numero totale di siti di legame è - generalmente - assegnato tale valore alla lettera theta:
$$\theta =\frac{\left [PL \right ]}{ \left [ PL \right ] + [P]}$$
Integrando theta alla la costante di associaziona Ka si ottiene:
$$\theta =\frac{\left [ L \right ]}{ \left [ L \right ] + \frac{1}{Ka} }$$
Oltre alla costante di associazione del complesso proteina-ligando è possibile tenere conto della costante di dissociazione Kd che è pari all'inverso di Ka. In altre parole:
$$K_{d}=\frac{1}{Ka}$$
che sostituito nella equazione di theta modifica diventa
$$\theta = \frac{\left [ L \right ]}{ \left [ L \right ] + K_{d} }$$
Quest'ultima funzione genera una curva iperbolica che nel caso della mioglobina è la seguente:
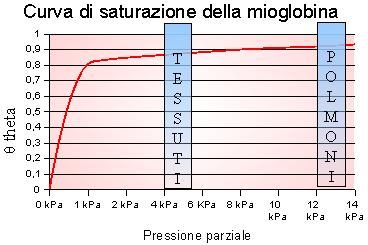
Curva della saturazione della mioglobina a livello polmonare.
Il grafico sopra proposto illustra i diversi valori che θ assume variando la pressione. Nel caso dei gas, e quindi di ossigeno, è opportuno tener conto della pressione parziale, in altre parole della pressione del gas in miscela che tale gas avrebbe avuto se in quel volume di miscela fosse presente da solo.
Il significato di P50
Fino ad ora, è stata illustrata la della curva di saturazione in modo generico ma è importante capire ogni suo punto. L'esempio della mioglobina calza a pennello perché illustra la progressione iperbolica con la quale tale molecola si satura in base alla pressione parziale del gas. Alla pressione parziale di 0kPA l'emoglobina non ha ossigeno, perché evidentemente lo ha rilasciato, mentre alla pressione di circa 10 kPa il valore di θ è prossimo all'asintoto orizzontale del sistema che è pari ad 1.
θ non può assumere valori maggiori di 1 in quanto vorrebbe dire che sono più i ligandi legati alla proteina che i siti realmente disponibili.
Il termine P50 è riferito alla pressione parziale nella quale la mioglobina, o qualsiasi altro proteina con un sito attivo, è satura al 50% di ossigeno, o del corrispettivo ligando. Il valore 50% riferito all'ossigeno non è casuale perchè si stima che in un soggetto sano il sangue del torrente venoso possieda una saturazione di ossigeno di circa il 60%, da contrapporsi alla saturazione di ossigeno nel torrente arterioso che è di circa il 98%.
La P50 della mioglobina è dunque la pressione parziale nella quale la molecola è satura al 50% di ossigeno e, nella realtà, tale valore è prossimo a 0,26 kPa.
Curva di saturazione dell'emoglobina
Nel corpo umano la pressione parziale dell'ossigeno non è uguale in ogni tessuto. A livello polmonare si attesta a circa 13 kPa mentre a livello tissutale decresce a circa 4 kPa. Questo vuol dire che l'affinità dell'emoglobina dovrebbe essere differente in base alla localizzazione tissutale. Nella biologia umana, questo fenomeno non si rileva e, per capire questo concetto, è possibile riproporre il grafico della mioglobina ponendo l'attenzione sui valori di pressione parziale del polmone e di un generico tessuto periferico.

Curva di saturazione della mioglobina nei polmoni e in altri tessuti.
Dalla curva si evince che nel polmone la mioglobina si saturerebbe con facilità ( θ > 0,8) ma alla pressione parziale tissutale la mioglobina avrebbe ancora un quantitativo elevato di ossigeno legato a sé ( θ > 0,8 ). Per questo motivo la mioglobina, in quanto molecola ad alta affinità per l'ossigeno, non è adatta per il trasporto e il rilascio. Idealmente neppure una molecola a bassa affinità sarebbe sufficientemente peculiare per il trasporto e rilascio di ossigeno in quanto avrebbe facilità di rilascio di ossigeno nei tessuti ma, contemporaneamente, difficoltà di legarsi ad esso nei polmoni.
La natura ha risolto elegantemente questo problema permettendo all'emoglobina di passare da uno stato ad alta affinità T ad uno a bassa affinità R.
Lo stato T è tipico della desossiemoglobina, in altre parole l'emoglobina che ancora non ha legato a sé l'ossigeno. In questo stato l'affinità per l'ossigeno è minima ma una volta che la molecola si lega ad uno dei quattro centri, progressivamente, l'emoglobina passa da T a R ed aumenta la propria affinità per l'ossigeno.
In questo modo la curva di saturazione dell'emoglobina diventa una curva sigmoide:

Curva di saturazione dell'emoglobina a livello dei tessuti e dei polmoni.
Alla pressione parziale di 13 kPa, riscontrabile nei polmoni, l'affinità per l'ossigeno è massima ed è relativamente semplice rilevare la saturazione dell'emoglobina ( θ > 0,8 ). Alla pressione tissutale, comunque, il cambiamento di conformazione T-R rende possibile che l'emoglobina abbia una affinità sufficientemente bassa tale da saturarsi solo al 50% ( θ = 0.5) determinando il rilascio di ossigeno ai tessuti periferici.
Modulazioni allosteriche dell'emoglobina
L'emoglobina è una molecola fondamentale per la vita animale. Per questo motivo deve riuscire ad adattarasi alle condizioni eterogenee che possono presentarsi all'interno dell'individuo.
Esistono diversi meccanismi atti a garantire un sufficiente grado di funzionalità della molecola che si traducono in importanti modulazioni allosteriche capaci di modificare il comportomanto dell'emoglobina. Queste sono, essenzialmente, l'effetto Bohr e l'effetto del BPG.
Effetto Bohr
L'emoglobina non trasporta soltanto ossigeno ma si fa carico di veicolare anche anidride carbonica e protoni. La forma protonata dell'emoglobina viene rappresentata all'equilibrio:
$$HHb^{+} + O_{2} \rightleftharpoons HbO_{2} + H^{+}$$
L'interazione dei protoni con l'emoglobina modifica il suo stato di affinità nei confronti dell'ossigeno. A livello tissutale si ha una maggiore concentrazione di protoni (pH = 7.2) e la modifica dell'emoglobina si riflette in una minore affinità per l'ossigeno. A livello polmonare il pH è leggermente basico (pH = 7.6) e l'emoglobina non protonata ha una maggiore affinità per l'ossigeno. L'emoglobina protonata, HHb+, ha una minore affinità per l'ossigeno e per questo motivo è coadiuvata a rilasciarlo nei tessuti periferici dove la concentrazione di protoni è maggiore. L'emoglobina non protonata, invece, è affine all'ossigeno si riscontra dove ci sono elevate concentrazioni di questo gas come avviene nei polmoni.
Effetto dell'1,3-bisfosfoglicerato
L'1,3-bisfosfoglicerato ha un effetto allosterico nei confronti dell'emoglobina in quanto modula una variazione dell'affinità della molecola nei confronti dell'ossigeno che interessa le zone tissutali periferiche.
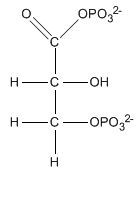
Formula di struttura dell'1,3-bisfosfoglicerato.
Alle alte quote la pressione parziale che si riscontra nei tessuti è radicalmente inferiore rispetto alla pressione parziale a livello del mare. L'andamento iperbolico della curva fa si che ad una variazione di poche centinaia di Pascal corrisponde un drastico aumento di θ che, in altre parole, vuol dire un minore rilascio di ossigeno ai tessuti. L'interazione allosterica del 1,3-bisfosfoglicerato rende possibile il rilascio del gas a pressioni parziali inferiori e, di fatto, modifica la curva di saturazione dell'emoglobina.
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?