Nome: *NA*
Nome alternativo:*NA*
EC:*NA*
Classe: {{{classe}}}
La
malato deidrogenasi è un enzima presente in diverse isoforme, che caratterizza nel
citoplasma e nel
mitocondrio la reazione di ossidazione del
malato in
ossalacetato. La presenza di più isoforme, rende la malato deidrogenasi un
isoenzima.
Reazione
La reazione generale catalizzata dalla malato deidrogenasi prevede l'ossidazione del malato in ossalacetato, con una reazione accoppiata di riduzione del NAD(P).
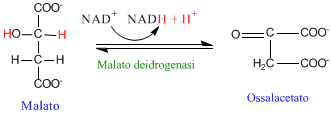
Malato deidrogenasi e ossidazione del malato in ossalacetato.
La reazione può essere reversibile ma, nel ciclo di Krebs, tende a spostarsi verso la formazione di ossalacetato per non rallentare il ciclo stesso. Le differenti isoforme della malato deidrogenasi accettano, come cofattore, il NAD a differenza delle isoforme del cloroplasto che utilizza il NADP come cofattore.
Meccanismo di reazione
La malato deidrogenasi segue una meccanismo a reazione ordinata, dove la prima molecola a legarsi è il NAD; a seguito di questo legame avviene una modifica conformazionale dell'enzima che porta alla chiusura del sito catalitico, che avviene grazie allo spostamento di una zona a loop, che permette la successiva catalisi enzimatica.
Modulazione
La reazione è fortemente modulata attraverso un complesso sistema di inibizione e modulazione positiva. L'aumento di malato determina una forte reazione di produzione dell'ossalacetato che, attraverso una inibizione da prodotto, blocca l'attività enzimatica. Il citrato, un intermedio del ciclo di Krebs, blocca la riduzione dell'ossalacetato in malato e, se la concentrazione di malato e di NAD è bassa, blocca anche l'ossidazione del malato in ossalacetato.
Inattivazione
L'enzima è sensibile ad alcune molecole, tra cui lo iodio e suoi derivati, compresa la tiroxina. Anche il cianuro è capace di inattivare l'enzima. Queste molecole, probabilmente, inattivano l'enzima attraverso l'ossidazione dei gruppo -SH.
Struttura
La malato deidrogenasi è un enzima a struttura omodimerica, giacché due identiche subunità sono legate tra loro. Ogni omodimero è formato da circa 350 aminoacidi. Negli eucarioti le forme citoplasmatiche e mitocondriali hanno una struttura tridimensionale simile, pur presentando una differente analogia nella struttura primaria.
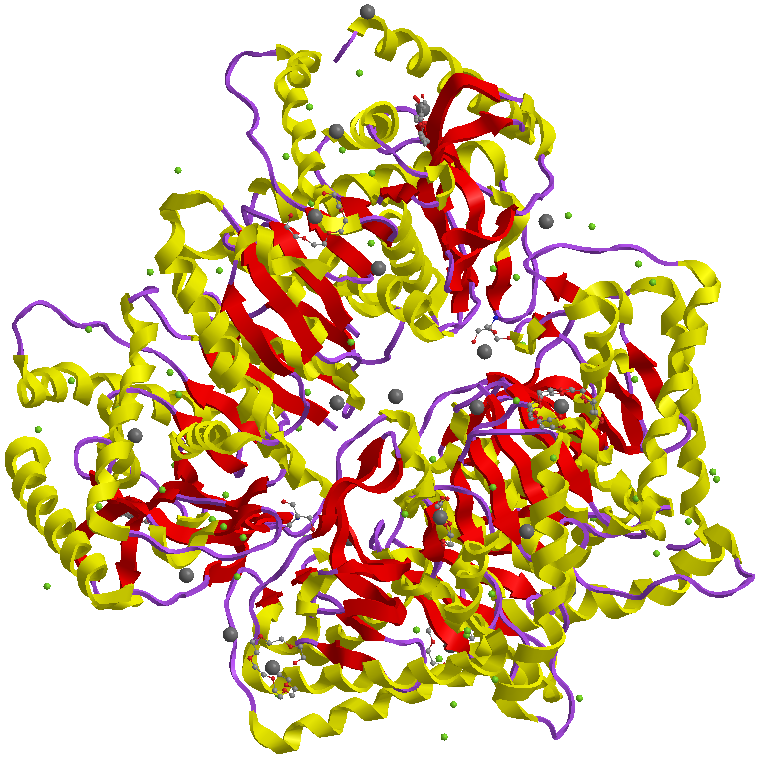
Struttura dell'enzima malato deidrogenasi, in forma "ribbon".
La sequenza degli aminoacidi mostra alcune, interessanti, proprietà giacché presenta alcune analogie tra specie diverse. Ad esempio, la sequenza primaria di Escherichia coli è simile alla sequenza dell'enzima mitocondriale degli eucarioti, mentre in Thermophylus flavus la sequenza appare molto simile a quella analizzabile nel citoplasma e nei cloroplasti.
Negli Archea, i procarioti più antichi, la struttura degli aminoacidi è molto simile ad un altro enzima, appartenente alla classe delle deidrogenasi: la lattato deidrogenasi.
Struttura quaternaria
La struttura quaternaria della malato deidrogenasi è caratteristica dell'enzima; la proteina si presenta omodimerica ed ogni monomero è legato all'altro monomero attraverso delle interazioni su una segmento a alfa-elica. Ogni subunità è formata da un foglietto beta, nella regione N-terminale, che accoglie il NAD(P) e da un dominio core formato da un segmento a alfa-elica e da quattro foglietti beta.
Isoforme
Nelle cellule eucariotiche esistono due isoforme della malato deidrogenasi, una è presente nel citoplasma ed è attivamente coinvolta nello shuttle del malato-asparato e l'altra è coinvolta, a livello del mitocondrio, nel ciclo di Krebs. Nei lieviti, la malato deidrogenasi è presente nel gliossisoma, e catalizza una reazione del ciclo del gliossilato.
Bibliografia
- Malate Dehydrogenases – Structure and Function. P. Minárik, N. Tomášková, M. Kollárová and M. Antalík. Gen. Physiol. Biophys. (2002), 21, 257—265.
Riepilogo delle classi enzimatiche
| Numero + Classe |
Descrizione |
Esempi |
| 1. Ossidoreduttasi |
Operano reazioni di ossidoriduzione. |
Alcol deidrogenasi |
| 2. Transferasi |
Operano reazioni di trasferimento di atomi o gruppi. |
Esochinasi, Chinasi |
| 3. Idrolasi |
Operano idrolisi sul substrato. |
|
| 4. Liasi |
Operano addizioni mediante doppi legami. |
|
| 5. Isomerasi |
Operano reazioni di isomerizzazione |
|
| 6. Ligasi |
Operano reazioni che portano alla formazione di legami. |
|
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?