Un peptide è un insieme di aminoacidi legati attraverso un legame peptidico; l'unione di più aminoacidi, attraverso una o più condensazioni, forma una catena peptidica che, per convenzione, può misurare fino a 40-50 unità aminoacidiche..
La reazione chimica che porta alla formazione del peptide è di condensazione; nella condensazione tra il gruppo aminico e il gruppo carbossilico di due differenti aminoacidi è allontanata una molecola di acqua.
I peptidi e - in genere - le proteine sono sintetizzati, nella maggior parte dei casi, al livello del ribosoma, un organuno del citoplasma che decodifica l'mRNA e, in base alla sequenza del codice, arruola i vari aminoacidi. Questo processo prende il nome di sintesi proteica. Una, piccola, aliquota di peptidi è sintetizzata dal complesso NRPS, generalmente utilizzato per la sintesi di piccoli peptidi che operano come antibiotici.
Classificazione dei peptidi
I peptidi si classificano in base alla lunghezza della catena. Il peptide più semplice è chiamato dipeptide ed è formato da due aminoacidi, non necessariamente differenti, legati tra loro. Tre aminoacidi formano un tripeptide. In linea generale, le catene con un numero inferiore di 10 aminoacidi prendono il nome di peptidi, mentre quelle con un numero compreso tra 10 e 50 prendono il nome di oligopeptidi.
Peptidi e oliogopetidi
| Dipeptide |
Glicilglicina. |
| Tripeptide |
Glutatione. |
| Oligopeptide |
Insulina, netropsina. |
Estremità N e C dei polipeptidi
Durante la sintesi proteica il primo aminoacido a essere inserito espone sempre l'estremità aminica e, per questa ragione, prende il nome di estremità N-terminale. Quando l'ultimo peptide è inserito, l'estremità libera è quella carbossilica e si riferisce a quel segmento come estremità C-terminale.
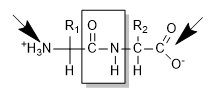
Estremità N-terminale e C-terminale di un aminoacido.
La presenza delle estremità N- e C-terminale è una caratteristica importante degli aminoacidi poiché, in molti casi, ha un marcato ruolo fisiologico. Inoltre, in Letteratura, le estremità terminali sono utilizzate per definire, dal punto di vista della posizione, la localizzazione di un aminoacido o di qualsiasi altro atomo/molecole a livello della catena peptidica che può essere vicino a una estremità N- o C- terminale.
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?