Le proteine o protidi rappresentano una vasta classe di molecole biologiche che, nel vasto contesto cellulare, possiedono differenti ruoli, strutture, proprietà e caratteristiche. Una proteina è formata da un insieme di aminoacidi legati tra loro mediante un legame peptidico e da altre molecole di natura non aminoacidica. Le proteine possono essere molto complesse, sia dal punto di vista strutturale sia funzionale. Per questa ragione, la presenza di proteine malformate può determinare alterazioni molto importanti del metabolismo, sia in termini della singola reazione sia in termini di modifiche sistemiche molto gravi.
La costruzione, e l'assemblaggio, delle proteine avviene grazie ai ribosomi, durante la fase finale della traduzione definita anche come sintesi proteica. Tuttavia, vista la complessità, e il gran numero di proteine potenzialmente sintetizzate da una cellula, la biosintesi delle proteine è un evento che può presentare diversi elementi di complessità.
Ruolo biologico
Il ruolo delle proteine, nei differenti contesti biologici, è molto eterogeneo. Una proteina, ad esempio, può far parte della membrana cellulare , assolvendo un ruolo strutturale e, sempre nel contesto della membrana, può servire da "ponte" di segnalazione tra l'ambiente esterno e il citoplasma. Altre proteine, possono servire nel sistema immunitario come sistema di rilevamento/segnalazione o di difesa. In linea generale, il pool proteico ha una scarsa funzione di riserva energetica, poiché questo compito è assolto dai carboidrati e dai lipidi; le proteine sono degradate in aminoacidi a seguito di un prolungato digiuno accompagnato dall'impossibilità di demolire le classi organiche appena elencate.
Ruolo biologico delle proteine
| Strutturale |
Offrono un supporto di tipo strutturale o meccanico, aumentando - ad esempio - la resistenza a stress di natura fisica.
Esempi: Actina, miosina, distrofina, dineina.
|
| Segnalazione |
Coordinano la comunicazione cellulare.
Esempi: Proteina G, recettori sensoriali generici.
|
| Immunogico/difensivo |
Coadiuvano, attivano oppure effettuano direttamente la risposta immunitaria.
Esempi: NOD-Like receptor, TOLL-like receptor, RIG-like receptor (recettori di membrana), immunoglobuline.
|
| Enzimatiche |
Catalizzano reazioni enzimatiche varie, ad esempio aggiunta o rimozione di gruppi funzionali.
Esempi: Glucochinasi, Anidrasi carbonica.
|
| Di riserva |
Proteine generiche che, in caso di necessità, sono catalizzate a fini energetici. Ad esempio, le proteine muscolari possono essere catabolizzate per ricavare carboidrati essenziali per la vita delle altre cellule, specialmente quelle del sistema nervoso.
|
Struttura delle proteine
Lo studio delle proteine, che confluisce nella cosiddetta proteomica, ha permesso di stabilire con l'utilizzo delle moderne tecnologie, che le proteine si strutturano in almeno tre differenti modelli: ad alfa-elica, a foglietto beta, a ripiegamento beta oppure a catena libera.I mattoni di costruzione della proteine sono rappresentati dagli aminoacidi che, legandosi tra loro, formano i polipeptidi. Un numero elevato di peptidi forma una proteina. Visto l'elevato numero di possibili combinazioni è virtualmente possibile la formazione di un numero illitato di strutture proteiche.
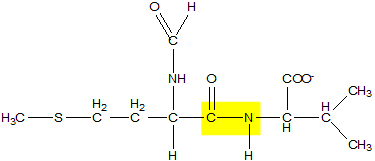
Legame peptidico tra due aminoacidi
Struttura primaria
La struttura primaria delle proteine descrive la sequenza lineare degli aminoacidi che compongono il polipeptide. È, generalmente, il diretto risultato della traduzione dell'mRNA. Una alterazione della struttura primaria proteica è potenzialmente capace di limitare la funzionalità della proteina stessa o, nei casi più estremi, renderla del tutto inutilizzabile
Struttura secondaria
La struttura secondaria delle proteine è apprezzabile dall'interazione degli aminoacidi attraverso la formazione del legame peptidico. La struttura secondaria permette lo sviluppo della proteina in pattern strutturali ordinati.
I differenti tipi di struttura secondaria sono:
- alfa-elica, con una forma regolare e ripetuta a forma di elica, normalmente destrogira;
- foglietto beta, con una forte presenza di legami tra il gruppo chetonico (R-C=O) di un aminoacido e il gruppo aminico (R-NH) di un altro aminoacido distante, solitamente, dieci aminoacidi;
- Ripiegamento beta, che è simile al foglietto beta ma la distanza di legame tra un aminoacido e un altro si limita a tre aminoacidi;
Struttura terziaria
La struttura terziaria di una proteina è direttamente correlata all'interazione degli aminoacidi nello spazio tridimensionale. Questi legami si instaurano grazie alle proprietà chimiche delle catene laterali.
Struttura quaternaria
La struttura quaternaria di una proteina è correlata alla presenza, nella stessa proteina, di più subunità costituenti. Le proteine, infatti, possono essere formate da più subunità, che sono singolarmente paragonabili a delle sezioni funzionali. Le subunità possono interagire sia con le altre subunità della proteina sia con elementi esterni. Un ligando, ad esempio, può legarsi in una subunità e determinare un cambio della conformazione quaternaria della proteina.
Turnover proteico
Il turnover proteico rappresenta una parte del metabolismo delle proteine nel quale, a seguito di degradazione, avviene un processo che bilancia l'omeostasi delle proteine attraverso la nuova sintesi. Il turnover proteico ha un ruolo importante: garantire l'efficienza dei sistemi proteici. Ad esempio, se non vi fosse una continua degradazione/sintesi degli enzimi l'organismo potrebbe soffrire della progressiva inefficienza delle strutture catalitiche proteiche. L'esposizione ad agenti mutageni, le reazioni con differenti strutture o molecole possono portare ad una parziale o totale inattivazione della funzionalità proteica. Il turnover proteico garantisce, in sintesi, la completa efficienza di tutte le strutture proteiche.
La regolazione del turnover proteico avviene grazie allo stimolo ormonale e dipende, in larga misura, dal tipo di proteina. Gli enzimi, ad esempio, sono soggetti a un minore intervallo di turnover rispetto alle fibre muscolari. La capacità dell'organismo di provvedere ad un adeguato turnover è subordinata alla presenza sufficiente degli aminoacidi; nelle fasi di carenza nutrizionale il turnover proteico rallenta a totale discapito dell'omeostasi e della salute dell'organismo.
Ruolo alimentare
Il ruolo alimentare delle proteine è di fondamentale importanza poiché, grazie alla presenza degli aminoacidi, intervengono attivamente nel metabolismo grazie alla loro capacità strutturale, coadiuvante del metabolismo e in misura minore energetica.
La presenza o l'assenza di determinati aminoacidi permette di classificare le proteine in base alla loro valenza nutrizionale. Le proteine che forniscono un pool di aminoacidi elevato, ricco specialmente in aminoacidi essenziali, sono definite ad alto valore biologico, mentre quelle povere in aminoacidi essenziali si definiscono a basso valore biologico. In linea generale, le proteine ad alto valore biologico sono rappresentate dal pool proteico presente nella carne e nel pesce, mentre nei cereali, nei legumi e, in genere, nei vegetali sono presenti insiemi proteici a basso valore biologico.

Il pesce rappresenta un alimento che fornisce una buona aliquota di proteine, ricche di aminoacidi essenziali. Per questo motivo, specialmente nelle diete a maggior beneficio per la salute, è un alimento consigliato.
Tuttavia, specialmente nella dieta vegetariana è possibile oltrepassare il limite della qualità biologica delle proteine attraverso l'abbinamento di diversi cibi che forniscono aminoacidi differenti. Ad esempio, il riso con i fagioli rappresenta un abbinamento complementare di diversi aminoacidi (essenziali e non) capace di fornire un complesso ad alto valore proteico.
Fonti alimentari di proteine
La carne, il pesce e i cereali rappresentano una buona fonte alimentare di proteine. La quantità proteica delle proteine presente nella frutta e nella verdura è trascurabile.
Fonti alimentari di proteine
| Classe alimentare |
Qualità delle proteine |
Integrazioni necessarie |
|---|
| Carne |
Ottima |
La carne presenta un vasto ed eterogeneo pool di aminoacidi, un consumo regolare e moderato di carne permette di assumere la quantità sufficiente, in un soggetto sano, di aminoacidi essenziali e non essenziali. |
| Pesce |
Ottima |
Il pesce, al pari della carne, offre un nutrito insieme di aminoacidi essenziali e non essenziali. |
| Frumento e derivati |
Buona |
Il frumento, e i derivati della lavorazione, possono essere carenti in alcuni aminoacidi essenziali, per questo motivo è necessaria l'integrazione con altre fonti alimentari. |
| Legumi |
Buona |
I legumi, al pari del frumento, possono fornire un limitato quantitativo di aminoacidi, specialmente essenziali. Il frumento, in altre parole, deve essere integrato con altre fonti alimentari per garantire una buona fornitura di aminoacidi essenziali e non. |
Dieta vegetariana e proteine
La dieta vegetariana rappresenta un regime alimentare nel quale l'apporto di carne o pesce, ambedue freschi o lavorati, è escluso. Per questa ragione, il regime vegetariano deve essere accuratamente bilanciato per garantire un accurato apporto in termini di proteine e di aminoacidi. L'alimentazione vegetariana, in tal senso, garantisce l'apporto di molecole combinando diversi cibi che, pur presentando differenti carenze in termini di aminoacidi, possono essere assunti per complementare l'apporto di nutrienti proteici.
La pasta e, in genere, i derivati della lavorazione dei cereali, contengono poca lisina (un aminoacido essenziale) ma sono ricchi in metionina. I legumi, invece, sono ricchi in lisina ma poveri di aminoacidi solforati. Per questo motivo, l'abbinamento di pasta e legumi permette di oltrepassare i rispettivi limiti, in termini di carenza di aminoacidi, e garantire un apporto nutrizionalmente valido.
Dieta vegana e proteine
La dieta vegana, a differenza della vegetariana, rappresenta un regime alimentare nel quale è escluso il consumo di carne e di pesce sia il consumo dei derivati animali quali, ad esempio, il formaggio o il latte. Nel regime vegano, per questa ragione, è necessario bilanciare ed abbinare gli alimenti per garantire un adeguato apporto proteico, in termini di assunzione di aminoacidi essenziali e non.
Digestione delle proteine
La presenza del legame peptidico conferisce una buona resistenza alla digestione delle proteine. Per questo motivo, gli eventi di digestione delle proteine non iniziano in bocca - a differenza, ad esempio, di quanto osservato nella digestione dei carboidrati - ma nello stomaco. Per effetto del pH e dell'ambiente estramemente acido, in virtù dell'azione dell'acido cloridrico, la proteina è progressivamente demolita.
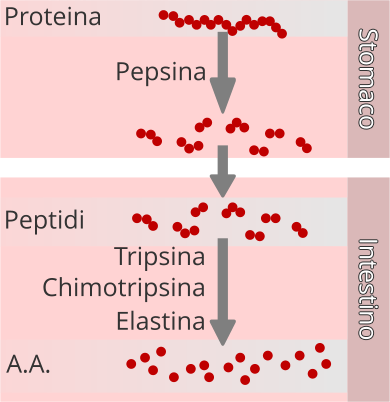
Fasi della digestione di una generica proteina. Nello stomaco, la proteina subisce una
idrolisi e viene scissa in piccoli peptidi. Nell'intestino, ad opera di un pool enzimatico, i peptidi sono scissi in singoli aminoacidi, subito disponibili per il metabolismo.
Nello stomaco, il pepsinogeno è attivato dall'ambiente fortemente acido. La reazione acida porta alla formazione della pepsina, un enzima che coadiuva la digestione delle proteine, portando alla formazione di catene molto semplici di aminoacidi. La proteina introdotta attraverso l'alimentazione è progressivamente demolita fino a lasciare lo stomaco sotto forma di tripeptide o dipeptide. Nel duodeno, per effetto della tripsina, della chimotripsina e della elastasi (enzimi capaci di operare su piccole catene peptidiche) termina la fase digestiva delle proteine con l'idrolisi dei di-, tri-peptidi e la liberazione dei singoli aminoacidi.
Pagine correlate
Introduzione ai carboidrati: Introduzione e classificazione dei carboidrati, Struttura e chiralità degli zuccheri, monosaccaridi, disaccaridi, polisaccaridi. Glucosio e mutarotazione del glucosio.
Introduzione ai lipidi: I lipidi
Introduzione agli aminoacidi: Aminoacidi, carica ionica degli aminoacidi, punto isoelettrico, legame peptidico.
Metabolismo degli aminoacidi: Transaminazione, ciclo dell'urea.
Metabolismo dei carboidrati: Glicolisi, , regolazione della glicolisi, regolazione del metabolismo del glucosio, gluconeogenesi, via dei pentoso fosfati, glicogenolisi. Regolazione del glucosio ematico.
Ciclo di Krebs: Decarbossilazione ossidativa del piruvato.
Introduzione alle proteine: Proteine e struttura (struttura primaria, struttura secondaria, struttura terziaria alfa-elica, foglietto beta), enzimi, emoglobina.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?