Un acido è una molecola che, in soluzione acquosa, rilascia ioni di idrogeno, contribuendo all'aumento dell'acidità della soluzione. La definizione di acido non è univoca poiché, nel corso degli anni, diversi contributi sperimentali hanno diversificato il concetto stesso di acido, fornendone definizioni che meglio si adattano all'analisi sperimentale.
La definizione di acido dipende, in larga parte, dal tipo di analisi effettuata sulle proprietà della molecola. L'attuale definizione di acido prende in considerazione l'aspetto legato agli orbitali molecolari definendo, in modo sperimentale, un cosiddetto acido di Lewis.
In linea generale, un acido è capace di far variare il pH di una soluzione acquosa portandolo a valori inferiori; questo vale a patto che nella soluzione non sia presente un sistema tampone tale da bilanciare oppure annullare l'attività dell'acido stesso.
Classificazione degli acidi
Gli acidi si classificano sia in base alla loro forza ionica sia in base alla loro provenienza. Un acido forte si dissocia totalmente, a differenza di un acido debole che, in soluzione acquosa, è dissociato solo parzialmente. Inoltre, gli acidi si classificano in acidi minerali, qualora presentino all'interno della struttura molecolare uno o più atomi non organici e acidi organici qualora presentino gruppi funzionali organici.
Esempi di acidi minerali e acidi organici
| Acido minerale |
Acido organico |
|---|
| Acido cloridrico (HCl) |
Acido acetico |
| Acido solforico (H2SO4) |
Acido ascorbico |
| Acido fluoridrico (HF) |
Acido citrico |
| Acido iodidrico (HI) |
Acido lattico |
Piogge acide
Normalmente la ricaduta pluviale ha un pH compreso tra 5 e 7, il pH leggermente acido deriva dalla reazione dell'acqua con l'anidride carbonica atmosferica, formante carbonato e lo ione idronio. Normalmente, i soluti presenti nella soluzione e il pulviscono non agiscono in modo netto nel viraggio del pH dell'acqua pluviale. Negli ultimi decenni, tuttavia, il viraggio del pH delle piogge verso valori più acidi ha allarmato gli esperti ambientali di tutto il mondo. Le
piogge acide sono il risultato di reazioni chimiche che portano all'acidificazione della soluzione. Nell'atmosfera sono immessi gas, specialmente anidride solforosa e ossido d'azoto, che reagiscono formando, rispettivamente, acido solforico e acido nitrico. Questi acidi amplificano gli effetti deboli dell'acidificazione portando a valori di pH inferiori al 5. Le piogge acide sono un problema per l'agricoltura, per i biomi e perfino per le costruzioni umane. Le piante subiscono profondi shock e possono rallentare il proprio
metabolismo, se non - in casi estremi - morire.
In genere, gli acidi minerali sono più forti degli acidi organici, poiché si dissociano con più facilità. In alcuni casi, tuttavia, quando l'idrogeno è legato a un atomo che risente dell'elettronegatività di altri atomi vicini, la facilità di dissociazione dell'idrogeno, e di conseguenza la sua acidità, è molto elevata. Ad esempio, l'acido tricloroacetico e l'acido tetrafluoroacetico sono due acidi organici molto forti.
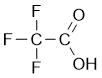
L'acido trifluoroacetico è un acido minerale molto forte.
Acido secondo la teoria di Arrhenius
Un acido, secondo la teoria di Arrhenius, è una qualsiasi molecola che, in soluzione acquosa, si dissocia per fornire uno ione idrogeno. Non tutte le specie si dissociano in egual modo, per questa ragione, Arrhenius propose che la forza di un acido è in relazione con la capacità di dissociarsi in acqua. Un acido forte, come l'acido cloridrico, in soluzione acquosa si dissocia totalmente a differenza di un acido debole, come l'acido acetico che, in acqua, permane in una stasi di equilibrio chimico tra forma protonata e forma deprotonata.
Acidi forti e acidi deboli
| Tipo di acido |
Esempio di reazione in soluzione |
|---|
| Acido forte |
HCl → H+ Cl- |
| Acido debole |
CH3COOH → CH3COO- + H+ |
Acido secondo la teoria di Bronsted e Lowry
La teoria di Arrhenius, nonostante sia aderente a molte analisi sperimentali, non riesce a spiegare l'attività acida di molecole che, al proprio interno, non possiedono atomi di idrogeno. La dissociazione di queste sostanze, infatti, non permette la "liberazione" di ioni idrogeno poiché non sono presenti nella struttura molecolare.
Per cercare di dare una spiegazione chimica, due chimici proposero - in modo del tutto indipendente - un modello attraverso il quale un acido non deve necessariamente possedere un atomo di idrogeno per dimostrare il suo comportamento in una soluzione acquosa. Secondo questa teoria, che in nome degli scopritori prende il nome di teoria acida di Bronsted e Lowry, un acido si definisce tale se è capace di donare protoni. Inoltre, deve essere capace, in soluzione, di trasformarsi nella corrispettiva base coniugata capace, successivamente, di accettare il protone. Ad esempio, in soluzione acquosa, l'acido cloridrico è un acido che, cedendo il protone, si trasforma in cloro, rappresentante la base coniugata. Accettando il protone, l'acqua, diventa l'acido coniugato.
$$\underset{Acido}{HCl} + \underset{Base}{H_{2}O}\rightarrow \underset{Base\ coniugata}{Cl^{-}} + \underset{Acido\ coniugato}{H_{3}O^{+}}$$
Acido secondo la teoria di Lewis
L'acido di Lewis è una molecola che è capace di ricevere un doppietto elettronico da una molecola capace di donarlo. Secondo la teoria acido-base di Lewis, in altre parole, il ruolo dell'idrogeno è marginale ma diventa preponderante l'attività di cessione dei doppietti elettronici operata dalle molecole.
Forza degli acidi: costante di ionizzazione acida
La forza degli acidi è rappresentata dalla tendenza che possiedono a dissociarsi in soluzione acquosa o, in altre parole, a cedere il protone. Dal punto di vista chimico la forza acida è misurata attraverso la costante di ionizzazione. Una generica reazione:
$$HA + H_{2}O \rightarrow H_{3}O^{+} + A^{-}$$
può essere calcolata attraverso la relativa costante di ionizzazione:
$$K_{a} = \frac{[H_{3}O^{+}][A^{-}]}{[HA]}$$
La costante di ionizzazione acida, o Ka, è indicativa della forza di un acido. Gli acidi forti possiedono una Ka superiore a 1, poiché al nominatore la concentrazione di specie dissociata è maggiore rispetto a quanto si verifica per un acido debole.
Logratimo della costante di ionizzazione acida: pKa
Nell'esperienza comune di laboratorio si è soliti utilizzare la costante di ionizzazione acida sotto forma di logaritmo negativo, espresso dall'operatore "p". In altre parole la pKa è uguale a -log(Ka).
Acidi monoprotici, acidi diprotici, acidi multiprotici
Quando una molecola è capace di donare un solo protone si definisce acido monoprotico. L'acido cloridrico, ad esempio, è un acido monoprotico poiché in soluzione acquosa si dissocia in un anione cloro e uno ione idrogeno. Alcune molecole, sequenzialmente, possono donare due o più atomi di idrogeno e, per questa ragione, si definiscono acidi diprotici e, generalmente, acido multiprotici. Qualsiasi acido multiprotico possiede differenti costanti di ionizzazione acida che sono, a partire dal primo idrogeno donato, ordinate in termini decrescenti.
Formazione degli acidi
I processi chimici di formazione degli acidi sono molteplici e sono, talvolta, utilizzati nell'industria per la produzione massiva e selettiva degli acidi minerali o organici.
Reazione tra non metalli ed acqua
La reazione tra i non metalli e l'acqua porta alla formazione di un acido debole, il cui comportamento è spiegabile attraverso la teoria di Bronsted-Lowry. Gli ossidi, per questa ragione, sono chiamati ossidi acidi. L'anidride carbonica, ad esempio, è un ossido acido che si discioglie in acqua (parzialmente) mediante le seguenti reazioni:
$$CO_{2} + H_{2}O \rightleftharpoons H_{2}CO{3}$$
L'acido carbonico (H2CO3) è un acido debole che, a sua volta, si dissocia in:
$$H_{2}CO_{3} + H_{2}O \rightleftharpoons HCO_{3}^{-} H_{3}O^{+}$$
Utilizzo industriale degli acidi
Gli acidi trovano vasto impiego nell'utilizzo industriale. Nell'industria siderurgica sono adoperati per pulire i prodotti finiti oppure in fase di lavorazione, ad esempio nella parte finale della formazione di strutture metalliche, l'acido cloridrico o l'acido solforico sono utilizzati per la pulizia e la levigazione del manufatto metallico nel processo chiamato pulitura acida.
Ruolo biologico degli acidi
La secreazione acida è operata dalle cellule ossintiche affondate nella mucosa dello stomaco; attraverso questo tipo cellulare è possibile la secrezione di acido cloridrico che, nel lume dello stomaco, provvede alla diminuzione del pH, favorendo l'attività di numerosi enzimi che operano a pH acidi.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?