In chimica, un dipolo molecolare è rappresentato da una molecola che presenta una disomogenea distribuzione delle cariche elettriche nello spazio tridimensionale, formando un dipolo elettrico. Una molecola neutra non presenta un dipolo poiché le cariche sono egualmente distribuite nello spazio, ad esempio le molecole omoatomiche (ossigeno molecolare, idrogeno molecolare, etc.) non presentano un dipolo poiché la struttura molecolare stessa impedisce la formazione di una carica ripartita in modo non eguale. Nelle molecole formate da atomi non appertenenti allo stesso elemento è possibile la formazione di un dipolo molecolare poiché gli stessi atomi, a causa della differente elettronegatività, tendono ad attirare verso di sé, con una forza diversa, gli elettroni.
Il dipolo molecolare può essere permanente, ad esempio a seguito della formazione di una molecola con legame covalente, oppure temporaneo nel caso del dipolo indotto. Un altro tipo di dipolo è quello che, in modo del tutto casuale, si forma in un atomo a seguito della presenza sbilanciata degli elettroni, formando una nube non elettricamente omogenea. Questo tipo di dipolo prende il nome di dipolo istantaneo ed è alla base del legame debole.
Dipolo indotto
Il dipolo indotto è un tipo di dipolo molecolare causato dalla presenza di una molecola con carattere di dipolo vicino a una molecola, iniziamente, neutra. L'effetto induttivo della molecola, che presenta un dipolo di carica, rende possibile l'attrazione degli elettroni della molecola neutra con la, successiva, formazione di una seconda molecola con carattere dipolare.
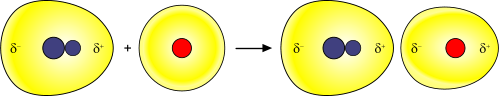
Forze di Debye e formazione di un legame indotto.
Dipolo istantaneo
Il dipolo istantaneo è un dipolo generato dalla momentanea presenza degli elettroni della guscio elettronico temporaneamente addensati in una determinata e limitata zona, formando così una parte spaziale con carica negativa e una parte con carica positiva. Il dipolo istantaneo, sebbene sia un evento di natura casuale, è alla base della formazione del legame debole.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?