Nell'ibridizzazione sp2 si vengono a formare tre singoletti elettronici che, pertanto, possono legare tre atomi. Il trifluoruro di boro è un ottimo esempio di ibridizzazione sp2. Allo stadio normale il boro, nella molecola del trifluoruro di boro, ha configurazione 1s2,2s2,2p1:
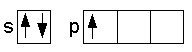
Ibridizzazione sp2 bf3 fondamentale
La somministrazione di energia al boro determina un passaggio di configurazione dallo stadio stazionario allo stadio eccitato e, di conseguenza, un elettrone singoletto passa all'orbitale p:
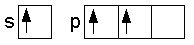
Passaggio dell'elettrone all'orbitale P
successivamente avviene l'ibridizzazione di sp:
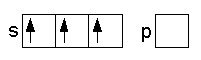
Ibridazione dell'orbitale sp
per questo motivo il boro può formare tre legami che, nel fluoruro di boro, sono adoperati con il fluoro formando la caratteristica molecola con angolo di 120°:
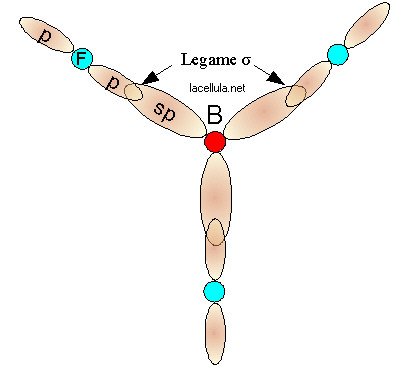
Fluoruro di boro.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?