La geometria molecolare descrive la struttura tridimensionale di una molecola e la disposizione degli atomi nello spazio attraverso l'analisi teorica della distribuzione degli elettroni e della disposizione degli atomi. I risultati teorici ottenuti possono essere, successivamente, analizzati attraverso la tecnica sperimentale per validare, oppure rigettare, la conformazione tridimensionale ipotizzata.
Comprendere la struttura tridimensionale di una molecola è di fondamentale importanza poiché molte caratteristiche chimiche e biologiche dipendono dalla sua conformazione tridimensionale. Inoltre, numerosi enzimi operano su specifiche forme molecolari e non su altre molecole che sono, anche solo lievemenete, differenti per struttura.
VSEPR
La VSEPR o Variance Shell Electronic Power Repulsion (repulsione delle coppie elettroniche nel guscio di valenza) è una importante teoria che descrive la geometria molecolare in base a semplici osservazioni teoriche. Attraverso la VSEPR, ad esempio, è possibile teorizzare l'effetto di una coppia di elettroni sulla disposizione degli atomi legati a un atomo centrale.
La migliore illustrazione teorica, relativa alla VSEPR, è quella di definire, idealmente, un atomo centrale e la relativa posizione degli altri atomi legati e di eventuali doppietti elettronici che compartecipano nella genesi della forma tridimensionale della molecola. Un grande vantaggio della VSEPR è proprio quello di valutare la disposizione tridimensionale, ipotizzando l'effetto di repulsione degli elettroni e degli stessi legami chimici nei confronti degli atomi.
La spiegazione teorica della VSEPR si basa su un concetto semplice: gli elettroni possiedono carica negativa e tendono a disporre, i relativi atomi di appartenza, alla massima distanza possibile. Per questa ragione, si formano delle strutture geometriche definite che, rispetto a quanto sperimentalmente verificato, si discostano soltanto per piccole frazioni.
VSPER e tipi di geometrie
| Geometria |
Modello molecolare |
Esempio di molecola |
|---|
| Lineare |
 |
Difluoruro di berillio (BeFl2) |
| Trigonale planare |
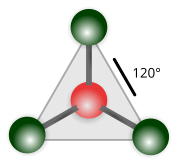 |
Trifluoruro di boro (BF3) |
| Tetraedica |
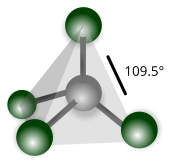 |
Trifluoruro di carbonio (CF4) |
| Trigonale bipiramidale |
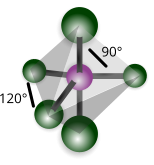 |
Pentafluoruro di fosfororo (PF5) |
| Ottaedrica |
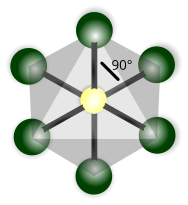 |
Esafluoruro di zolfo (SF6) |
Negli esempi sopra riportati, gli atomi sono "idealmente" centrali e l'interazione degli elettroni non è considerata poiché trascurabile. Tuttavia, in alcune molecole, il doppietto elettronico interagisce con il guscio elettronico degli altri atomi; vista la carica negativa gli atomi sono respinti dal doppietto elettronico "libero" e, per questo motivo, la gemetria molecolare è fortemente influenzata dai doppietti elettronici spaiati.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?