Si definisce isotopo un atomo di un elemento chimico che possiede un diverso numero di massa, definito con la lettera A, ed un uguale numero atomico, definito con la lettera Z. Gli isotopo possono essere stabili o instabili, in quest'ultimo caso si parla di isotopi radioattivi. Gli isotopi che appartengono a un determinato elemento chimico variano sempre il numero di neutroni e mai il numero di protoni.
Graficamente, un isotopo è riportato mediante la rappresentazione del numero di massa subito dopo il nome dell'elemento oppure, qualora venisse riportato il simbolo, il numero relativo al numero di massa in alto a sinistra rispetto al simbolo.
Esempi di isotopo
| Elemento |
Numero di massa |
Nome dell'isotopo |
|---|
| Uranio-238 |
238 |
238U |
| Deuterio |
2 |
2H |
| Trizio |
3 |
3H |
In alcuni casi, la presenza di un isotopo predomina rispetto alle aliquote degli altri isotopi, introducendo un concetto di "abbondanza".
Esempio: isotopi dell'idrogeno
In natura, l'idrogeno è un elemento presente in gran quantità sia nelle molecole semplici sia in quelle più complesse come ad esempio i grassi o gli zuccheri. La maggior parte dell'idrogeno è presente sotto forma di prozio, che rappresenta un isotopo senza neutroni; piccole percentuali di idrogeno sono formate dagli altri due isotopi di questo elemento che prendono il nome di deuterio e trizio.
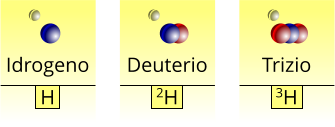
Isotopi dell'idrogeno: deuterio e trizio
Il deuterio presenta un neutrone nel proprio nucleo, pertanto rispetto al prozio possiede un numero di massa maggiore di una unità, mentre il trizio possiede due neutroni in più ed è fortemente radioattivo.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?