Un legame debole, sebbene questa dicitura non sia del tutto corretta poiché può essere confusa con una delle forza fondamentale in ambito fisico, o forza di Van der Waals è un legame che si instaura tra due o più molecole e, di conseguenza rappresenta un legame intermolecolare. La caratteristica dei legami deboli è che possono indifferentemente formarsi tra molecole polari e non polari.
La formazione di un legame debole avviene tra molecole neutre che, in altre parole, non presentano una carica ionica positiva o negativa.
Classificazione dei legami deboli
Il criterio principale attraverso il quale si classificano i legami deboli riguarda la polarità delle due molecole coinvolte nella formazione del legame. I legami deboli, per la loro natura, sono incapaci di permanere qualora le molecole si distanzino tra loro, per questa ragione la distanza intermolecolare non è tenuta in considerazione.
- Forze di Keesom. Legame debole che si instaura tra molecole polari.
- Forze di Debye. Legame debole che si instaura tra molecole polari e non polari.
- Forze di London. Legame debole che si instaura tra molecole non polari.
Forze di Keesom
I legami tra molecole che presentano un momento di dipolo, dunque una polarità asimmetrica, tendono ad attrarsi avvicinando le estremità con cariche opposte. È possibile alterare la formazioni dei legami di Keesom agendo sulla temperatura. Fornendo calore ad un sistema, l'energia cinetica del sistema vince l'energia del legame debole e allontana le molecole, disperdendole in forma di gas. Viceversa, quando la temperatura diminuisce, le molecole si attraggono ponendosi in conformazione orientata.
Forze di Debye
Le forze di Debye sono definite forze intermolecolari dipolo-permanente dipolo-indotto, poiché si formano dall'avvicinamento tra molecole polari, che presentano un dipolo, verso molecole non polari.
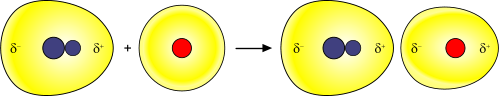
Formazione di un dipolo indotto a seguito dell'attrazione della nube elettronica di una molecola apolare da parte di una molecola polare. Il fenomeno prende il nome di processo di induzione.
La polarizzabilità è un valore, tipico per ogni molecola o per ogni atomo, che indica la tendenza della nube elettronica a polarizzarsi verso il polo positivo di una molecola polare. La polarizzabilità, dunque, dipende dalla caratteristiche dell'atomo o della molecola e aumenta all'aumentare della massa atomica, giacché a un egual numero di protoni corrisponde un egual numero di elettroni.
Forze di London
Le forze di London rappresentano le forze che legano due o più molecole neutre, attraverso un'interazione molto debole. Nonostante la carica netta di una molecola non polare, dunque elettricamente neutra, sia pari a zero, e nonostrante la nube elettronica sia egualmente dispersa nello spazio, è possibile che, in un determinato momento, si verifichino delle condizioni particolari proprio a carico della nube elettronica. Normalmente, la dispersione elettronica è uniforme ma, casualmente, è ipotizzabile che gli elettroni siano asimmetricamente disposti nelle zone circondanti l'atomo, portando alla formazione di un dipolo istantaneo. La molecola che presenta un dipolo istantaneo può modificare la distribuzione della nube elettronica di una molecola non polare e, di conseguenza, modificare la stessa molecola attraverso la formazione di un dipolo indotto.
Nelle forze di London si forma un sistema dipolo istantaneo - dipolo indotto, dalla forza trascurabile ma sufficiente per alterare la disposizione elettronica e formare un legame molto debole.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?