La tavola periodica o tavola periodica degli elementi è una rappresentazione schematica degli elementi chimici ordinati secondo il criterio del numero atomico. È uno strumento di fondamentale importanza sia teorica che pratica, poiché permette di avere sott'occhio le proprietà degli elementi e numerose altre informazioni.
Attraverso la classificazione operata nella tavola periodica è possibile, in forma visiva, raggruppare gli elementi che possiedono proprietà chimiche simili.
Gruppi e periodi
Le righe della tavola periodica rappresentano i periodi, le colonne i gruppi. L'attuale convenzione IUPAC suggerisce di identificare con numeri sia i 7 periodi sia i 16 gruppi rispettivamente con un ordine crescente dall'alto verso il basso e da sinistra verso destra.
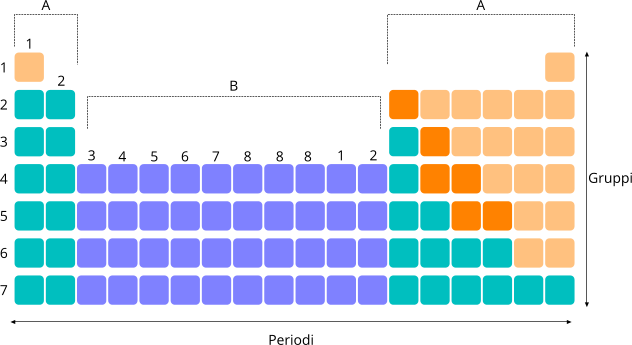
Suddivisione in gruppi e periodi della tavola periodica degli elementi.
Periodi della tavola periodica
I periodi della tavola periodica sono identificati nelle righe. Procedendo da sinistra verso destra alcune proprietà variano con cadenza "regolare":
Il periodo della tavola periodica è strettamente legato al numero quantico principale o N. Il Neon, un gas nobile appartenente al secondo periodo ha configurazione elettronica 2s2 2p6. Il Krypton, appartenente al quarto perido ha configurazione 4s2 4p6.
Gruppi della tavola periodica
I gruppi della tavola periodica sono 16 e indicano le colonne. Tutti gli elementi appartenenti al medesimo gruppo possiedono la medesima configurazione elettronica e, di conseguenza, possono creare un legame con gli stessi elementi. Gli elementi che fanno parte del gruppo A sono chiamati elementi dei gruppi principali, mentre gli elementi del gruppo B sono definiti elementi di transizione.
L'attuale nomenclatura IUPAC assegna un numero ad ogni singolo gruppo di elementi, a partire dal numero 1 per arrivare al numero 16.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?