L'assorbanza di un campione rappresenta un valore di analisi, definita come il logaritmo negativo della trasmittanza]. È un parametro chiave per l'analisi, in spettrometria dei campioni, al fine di valutare la concentrazione della specie in oggetto di studio all'interno della soluzione.
Attraverso lo studio dell'assorbanza è, infatti, possibile risalire con una buona precisione alla concentrazione dei soluti disciolti in soluzione, un dato che risulta utile nella moderna industria chimica sia analitica sia di produzione.
Correlazione tra assorbanza e trasmittanza
La correlazione tra assorbanza e trasmittanza è molto stretta poiché al crescere della prima decresce la seconda. In altre parole, maggiore è la concentrazione della specie nel campione in analisi, maggiore è l'assorbanza e minore è la trasmittanza.
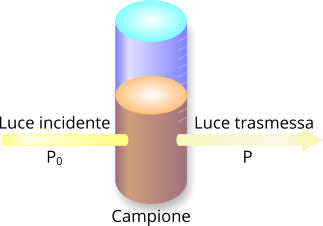
Trasmittanza e assorbanza in un campione in analisi sperimentale.
La spiegazione della correlazione inversa tra assorbanza e trasmittanza è sperimentalmente dimostrabile: un campione concentrato ostacola maggiormente il passaggio della luce rispetto a un campione meno concentrato.
Diametro del contenitore e assorbanza
Affinché una comparativa di assorbanza (e di trasmittanza) sia valida tra due o più campioni, è necessario che i contenitori di riferimento possiedano un eguale diametro. Quando la luce attraversa un contenitore di maggiore diametro, l'assorbanza aumenta, rispetto a un contenitore che presenta un campione alla stessa concentrazione ma con un diametro diverso. Per questa ragione, la legge di Lambert Beer (A = ε · l · c) tiene in considerazione la dimensione lineare del campione, con un parametro chiamato cammino ottico.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?