Il guscio elettronico, in chimica, rappresenta lo strato più esterno al nucleo atomico. Nel guscio, gli elettroni, si dispongono in uno o più orbitali atomici. Il riferimento a un guscio deriva dal fatto che il nucleo, a causa della sua carica netta positiva, è a distanza più o meno elevata rispetto agli elettroni. Tra il guscio e il nucleo, in alte parole, si interpone uno spazio.
La presenza di un guscio elettronico fu ipotizzata da Rutherford che, nel suo modello atomico di Rutherford e grazie all'omonimo esperimento, permise di stabilire che l'atomo è formato da una serie di particelle cariche positivamente, che formavano il nucleo, e da un guscio esterno carico negativamente. Secondo Rutherford, queste particelle erano gli elettroni e orbitavano attorno al nucleo come i pianeti orbitano attorno al sole. Per questa ragione, l'atomo di Rutherford fu ribattezzato atomo a modello planetario.
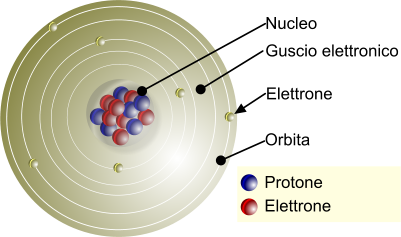
Schematizzazione di un atomo e ipotetica presenza di un guscio elettronico
Meccanica quantistica del guscio elettronico
Il modello planetario di Thomson mostrava degli evidenti limiti qualora si tentasse di associare il moto delle particelle alla teoria fisica classica, dunque alla meccanica classica. Gli elettroni, attratti dal nucleo, avrebbero dovuto progressivamente perdere energia ed emettere fotoni ma così non era. Le regole che governano le forze in gioco nel guscio elettrononico saranno, successivamente, illustrate dalla meccanica quantistica, attraverso la quale è possibile elaborare e verificare sperimentalmente le zone, chiamate orbitali atomici all'interno delle quali si forma una probabilità di trovare un elettrone.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?