Un legame chimico è una associazione di natura elettrostatica, attraverso la quale un atomo, oppure una molecola si lega a un atomo oppure a un'altra molecola, e viceversa. Esistono differenti tipi di legame chimico, classificati in base a parametri di natura chimico-fisica. Qualsiasi legame chimico, in modo del tutto indifferente dalla natura dello stesso, o dal tempo trascorso dalla formazione, può essere rotto.
La presenza dei legami chimici garantisce alla sostanza delle proprietà, sia fisiche che chimiche, che altrimenti non si riscontrerebbero negli atomi formanti. Ad esempio, la maggior parte degli atomi è presente allo stato aeriforme; l'associazione degli atomi in molecole permette la formazione di altri stati, ad esempio solido o liquido con le rispettive proprietà intrinseche.
Classificazione dei legami chimici
Una prima classificazione dei legami può essere fatta in base al tipo di interazione che, attraverso il legame stesso, si stabilisce sia all'interno della molecola sia all'esterno. I legami primari sono tutti i legami intramolecolari, ad esempio presenti tra l'idrogeno e l'ossigeno di una molecola d'acqua, mentre i legami secondari sono i cosiddetti legami intermolecolari, che tengono unite le molecole per evitare che diffondano tra lo spazio.
I legami primari sono definiti legami forti, difficili da rompere, mentre i legami intermolecolari sono classificati come deboli. In altre parole, le interazioni tra le molecole - classificate come legami secondari - sono più facili da rompere rispetto ai legami intramolecolari.

Esempio di legame primario e legame secondario nella molecola di acqua.
Stabilità del legame
Qualsiasi sistema termodinamico è maggiormente stabile al diminuire dell'energia interna. Una molecola possiede una quantità di energia interna inferiore rispetto alla somma dell'energia interna dei singoli atomi che la compongono, per questa ragione la formazione di un legame è possibile in modo spontaneo (senza l'intervento esterno rispetto al sistema) ma non è, invece, possibile la rottura.
La stabilità del legame non riguarda soltanto la tendenza del complesso a raggiungere, e permanere, in uno stato a minore energia, ma deriva anche dalla tendenza degli elettroni a raggiungere la configurazione elettronica del gas nobile che li segue o li precede nella tavola periodica. Questa caratteristica, conosciuta anche come regola dell'ottetto, è verificabile considerando che gli atomi sono stabili quando la loro configurazione elettronica esterna, cioè degli elettroni di valenza, è pari a s2p6. Per ottenere questa stabilità, gli atomi mettono in condivisione gli elettroni portando alla formazione di diversi tipi di legame.
Energia di legame
L'energia di legame è la quantità di energia necessaria a rompere un numero di avogadro di legami presenti in una mole di molecole presenti sotto forma di gas. L'energia di legame quantifica, in altre parole, la forza del legame poiché all'aumentare dell'energia necessaria per la rottura del legame aumenta anche la forza del legame stesso; i legami primaria hanno un livello di energia di legame centinaia di volte superiore rispetto ai legami secondari. Al contrario, la formazione di un legame libera sempre energia.
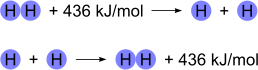
Energia di legame nella formazione del legame idrogeno.
L'energia di legame può essere intesa come la differenza di energia degli atomi non legati, e l'energia potenziale della molecola formata.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?