Il modello atomico di Thomson, è un modello atomico proposto dal fisico britannico Joseph John Thomson secondo il quale l'atomo è una struttura fortemente compatta, formata da numero uguale di particelle cariche positivamente protoni ed elettroni. Per questa ragione, comunemente, il modello di Thomson è anche definito modello a panettone poiché gli elettroni sono presenti all'interno della struttura atomica, dispersi in modo casuale.
L'esperimento di Thomson è antecedente alla scoperta del nucleo atomico e della sua caratterizzazione in termini sia fisici che chimici. Questa caratteristica temporale rendeva plausibile l'ipotesi secondo la quale la struttura dell'atomo fosse compatta, senza la presenza alcuna di spazi, poiché soltanto attraverso l'esperimento di Rutherford si iniziò a comprendere la reale struttura di un atomo, formato da un nucleo, molto piccolo, e da un pool di elettroni che ruota attorno ad esso.
La carica netta dell'atomo è neutra poiché il numero di particelle cariche negativamente, gli elettroni, bilancia esattamente il numero di particelle con carica positiva, i protoni.
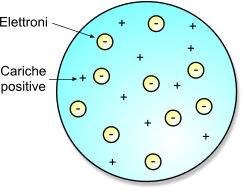
Schematizzazione dell'atomo di Thomson, definito anche struttura a panettone.
Importanza del modello atomico di Thomson
La proposta di Thomson, relativa alla presenza di una struttura atomica fortemente compatta, sebbene contestata in seguito da Rutherford e da Bohr, fu di enorme importanza poiché permise, per la prima volta, di osservare gli elettroni, inizialmente definiti come particelle.
La scoperta di una particella con carica negativa permise di definire alcune, importanti, proprietà dell'atomo. La spiegazione sulla ionizzazione, sul passaggio di corrente elettrica e anche sulla possibilità di legame iniziarono a confluere sul ruolo attivo degli elettroni.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?