In chimica, un orbitale atomico o semplicemente orbitale, è una regione dello spazio dell'atomo nel quale vi è una certa probabilità di trovare un elettrone.
Il concetto di orbitale è strettamente legato alla caratterizzazione quantistica dell'atomo, secondo la quale le leggi della meccanica che governano le particelle subatomiche, tra le quali anche l'elettrone, sono profondamente diverse dalle leggi fisiche della meccanica classica. Per questa ragione, anche il moto dell'elettrone intorno al nucleo atomico è diverso, giacché esso si muove lungo l'orbitale e non in un'orbita che, come tale, è precisa e verificabile in ogni singolo punto e istante.
L'indeterminazione è uno degli aspetti principali della teoria quantistica, secondo la quale non è possibile conoscere con esattezza la velocità di un elettrone e la sua posizione nello spazio. In altre parole, la precisione con la quale si tenta di misurare la velocità di un elettrone nello spazio aumenta proporzionalmente all'errore ottenuto nel calcolo della sua posizione, e viceversa.
La densità di probabilità è determinata dal quadrato della funzione d'onda che, dal punto di vista matematico, si definisce in Ψ2. La funzione d'onda (Ψ) è strettamente associata all'elettrone poiché esso possiede una natura dualistica: particellare e ondulatoria.
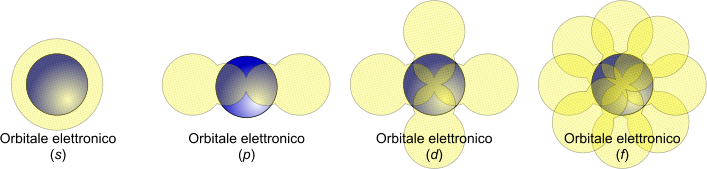
Schematizzazione degli orbitali atomici (s, p, d e f)
Sottolivelli degli orbitali s, p, d ed f
I sottolivelli energetici, si riferiscono ai possibili stati di energia, determinati dal numero quantico secondario (l). In altre parole, ciascun livello di energia, corrispondente al numero quantico principale (n), può possedere dei sottolivelli (l) il cui numero è pari al quadrato del numero quantico principale. Il livello di energia n=1 avrà un solo sottolivello, o sotto-orbitale, il livello di energia n=2 ne avrà quattro, il livello di energia n=3 ne avrà nove.
Sottolivelli energetici (l)
| N |
L |
|---|
| 1 |
1 |
| 2 |
4 |
| 3 |
9 |
| 4 |
16 |
L'energia associata ai sottolivelli è differente e segue l'ordine: Es < Ep < Ed < Ef. L'energia totale del livello è data dalla somma sia n sia di l. Gli elettroni si dispongono in base a livelli crescenti di energia, questo determina un riempimento che non segue sempre il valore crescente di n, poiché in alcuni sottolivelli l'energia è maggiore rispetto a un sottolivello appartenente a un altro sottolivello facente parte di un livello superiore. La prima dimostrazione della maggiore energia di un sottolivello si osserva nel riempimento elettronico durante il passaggio da 4s a 3d. L'ordine di riempimento degli orbitali tiene conto dell'energia totale.
Densità di probabilità
All'interno di un orbitale è probabile trovare un elettrone ma non vi è alcuna certezza né sulla sua presenza né sulla sua velocità istantanea. In altre parole, l'orbitale è quella zona che avvolge il guscio atomico all'interno della quale la densità di probabilità di trovare un elettrone è maggiore rispetto ad altre zone.
Orbitali e legami
Il legame chimico tra due o più atomi è affine alla disposizione degli elettroni nei loro rispettivi orbitali, sia in termini di possibilità di legame, sia del numero di legami sia per quanto riguarda la disposizione tridimensionale della molecola.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?