La configurazione elettronica, in riferimento a un elemento chimico, illustra la disposizione degli elettroni nel guscio elettronico. Il guscio, a sua volta, è idealmente la parte più esterna dell'atomo nella quale sono presenti gli elettroni. La collocazione degli elettroni, in accordo con la teoria atomica di Bohr, non è casuale. Gli elementi che concorrono a definire la disposizione esterna elettronica derivano direttamente dal livello energetico.
Il processo di configurazione elettronica rappresenta un percorso teorico molto complesso che prevede la conoscenza di alcune nozioni di base. Queste nozioni sono le seguenti:
- Orbitale atomico. Zona esterna dell'atomo nella quale è presenta un'alta probabilità di incontrare un elettrone.
- Livello energetico. Energia associata a un orbitale, oppure a un sotto-orbitale, che cresce allontanandosi dal nucleo. Ne consegue che gli orbitali più vicini al nucleo possiedono energia minore rispetto agli orbitali più lontani.
- Numero atomico. Pari al numero di protoni presenti in un atomo. Negli elementi non ionici il numero di elettroni è pari al numero dei protoni. Negli ioni, invece, è pari alla somma del numero atomico con la carica ionica qualora l'elemento fosse un anione oppure alla sottrazione qualora fosse un catione.
Livello energetico e orbitale atomico
Il livello energetico descrive una regione definita attorno al nucleo nel quale vi è una probabilità di presenza di uno o più elettroni. Questa porzione è definita orbitale atomico. Lo spazio descritto da un orbitale atomico deriva dal quadrato della funzione d'onda (Ψ2).
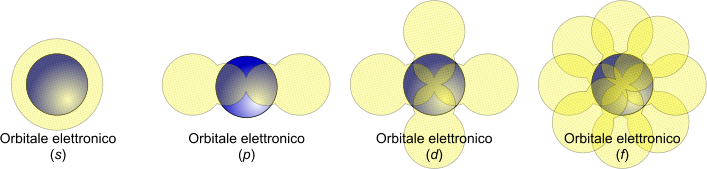
Immagine esemplificativa dei principali orbitali atomici.
Gli elettroni, in altre parole, muovendosi attorno al nucleo occupano un orbitale che rappresenta una zona dello spazio con una probabilità più o meno alta di trovare un elettrone. Gli orbitali più interni possiedono minore energia rispetto agli orbitali esterni. All'aumentare del numero degli elettroni aumenta il numero di orbitali occupati e, di conseguenza, l'energia totale associata all'orbitale.
Configurazione elettronica
La configurazione elettronica degli elementi rappresenta l'applicazione delle teorie e dei modelli che descrivono il comportamento degli elettroni attorno al nucleo.
La configurazione elettronica tiene conto di alcuni parametri: il numero quantico principale, il numero quantico secondario e lo spin degli elettroni. Il numero quantico principale corrisponde al livello energetico ed è compreso tra 1 e 7. Il numero quantico secondario, in realtà espresso con una lettera tra s-p-d-f, rappresenta il sottolivello energetico e anche la forma dell'orbitale. Lo spin rappresenta il senso di rotazione dell'elettrone, da intendersi come momento di rotazione.
Dalle considerazioni quantistiche sull'atomo, si ricava che il primo livello energetico possiede un solo orbitale (1s) il secondo livello energetico possiede due orbitali 2s e 2p, il terzo livello due orbitali e via dicendo.
Per analizzare, in modo corretto, la configuraizone elettronica di un atomo si deve tener conto di tre aspetti: la legge di esclusione di Pauli, il riempimento a minore energia (Aufbau) e la regola di Hund.
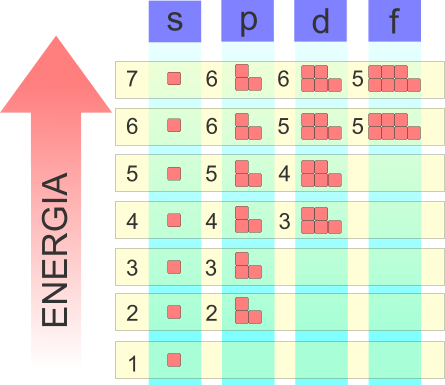
Schematizzazione della configurazione elettronica di un atomo
Regole per la configurazione elettronica
Affinché la configurazione degli orbitali elettronici sia corretta, è necessario osservare alcune regole che servono per la corretta collocazione degli elettroni negli orbitali, nei sotto-orbitali e per la corretta assegnazione dello spin. Le principali regole da seguire per configurare in modo corretto la disposizione elettronica di qualsiasi atomo sono le seguenti:
- Regola di Aufbau o riempimento a minor energia.
- Legge di esclusione di Pauli.
- Regola di Hound.
Riempimento a minore energia
La disposizione degli elettroni avviene in modo progressivo, seguendo la regola di Aufbau: dapprima sono riempiti gli orbitali a minor energia, rappresentati dagli orbitali con più basso numero quantico principale, e successivamente, una volta riempiti i sotto-orbitali relativi, si procede al numero quantico principale maggiore.
Legge di esclusione di Pauli
Il riempimento degli orbitali, inoltre, segue la legge di esclusione di Pauli che afferma:
"In un atomo non possono esistere elettroni con i numeri quantici n, m, l e ms (rispettivamente principale, azimuthale, magnetico e di spin). È possibile che due elettroni condividano i primi tre numeri quantici a condizione che il numero di spin (ms) sia differente."
La Legge di esclusione determina un aspetto importante che determina la configurazione degli elettroni, specialmente nei sotto-orbitali. Qualsiasi sotto-orbitale può ospitare due elettroni a patto che il loro numero di spin sia inverso. Questa legge è graficamente riportata associando la rappresentazione grafica tramite freccia con orientamento diverso.
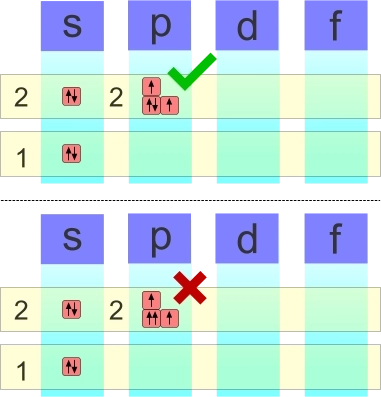
Configurazione grafica di due elettroni che condividono lo stesso sotto-livello energetico. In alto la corretta conformazione del livello 2s-2p. Lo spin degli elettroni è enfatizzato dall'orientamento diverso (verso l'alto e verso il basso) delle freccette.
Regola di Hund
La regola di Hund afferma che in caso di orbitali degeneri (2s-2p,3s-3p,4s-4p-3d ...) gli elettroni si dispongano con spin parallelo. La regola è graficamente illustrata attreverso la raffigurazione di elettroni con il medesimoorientamento. Per convenzione si utilizzano dapprima le frecce con orientamento verso l'alto e, successivamente, verso il basso.
Esempi di configurazione elettronica
La configurazione elettronica di alcuni elementi, comuni, è d'aiuto per la comprensione delle regole in precedenza descritte.
Configurazione elettronica di alcuni elementi
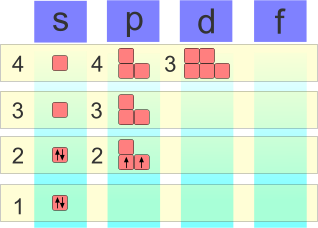
Configurazione elettronica del carbonio
|
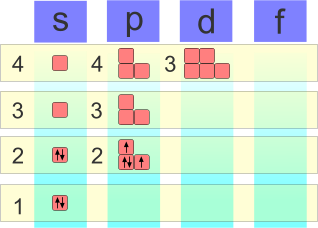
Configurazione elettronica dell'ossigeno.
|
|
| La configurazione atomica del carbonio è 1s2, 2s2, 2p2. |
La configurazione atomica dell'ossigeno è 1s2, 2s2,2p4. |
|
Per configurare gli elettroni del carbonio è necessario conoscere il suo numero atomico che è pari a 6 (N=6); in un atomo neutro il numero di elettroni è sempre uguale al numero di protoni e, per questo motivo, gli elettroni da configurare sono 6. Il primo livello (n=1) può contenere una coppia di elettroni nel sotto-orbitale s, il secondo livello (n=2) ne contiene una coppia nel sotto-orbitale s e ben tre coppie nel sotto-orbitale p. Due elettroni sono già configurati in 1s, ne rimangono sei che si dispongono in questo modo:
- Una coppia nel sotto-orbitale s;
- Due elettroni spaiati nel sottorbitale p, in accordo alla regola di Hund.
Per questa ragione la configurazione elettronica del carbonio è 1s2 2s2 2p2.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?