L'energia di legame rappresenta la quantità di energia necessaria per rompere un legame chimico di una molecola. È espressa in kJ/mol.
Durante la formazione di una molecola, parte dell'energia presente all'interno degli atomi in fase di legame, non è trasferita alla molecola finale e, per questa ragione, porta la neonascente molecola a un livello inferiore di energia. Un sistema è tanto più stabile quanto meno energia possiede. Somministrare energia a una molecola, che rappresenta un sistema stabile, vuol dire destabilizzarlo fino alla rottura con un conseguente ritorno dei singoli atomi componenti o, comunque, di frazioni più o meno grandi della molecola.
Non esiste una energia di legame "standard" poiché diverse molecole, anche in base alla forza del legame chimico, possiedono altrettanto differenti energie di legame.
Repulsione ed attrazione
La maggiore distanza dei nuclei provoca un aumento della repulsione degli atomi, a causa della presenza ravvicinata di cariche positive. Al contrario, la distanza ottimale, che varia da molecola a molecola, rende il sistema più stabile con la possibilità di formazione di un legame che abbassa l'energia potenziale e permette la formazione della molecola.
Energia di legame dell'idrogeno
L'idrogeno molecolare (H2) possiede una energia di legame pari a 432 kJ/mol e, allo stesso tempo, possiede una lunghezza di legame di 74pm. Questo vuol dire che è necessario somministrare 432 kJ per rompere una mole di legami nell'idrogeno molecolare. Allo stesso tempo, la formazione di una molecola di idrogeno molecolare avviene a 74pm e libera 432kJ per ogni mole di legami tra l'idrogeno che si forma.
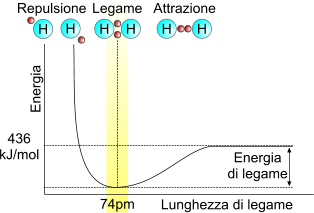
Energia di legame nella molecola di idrogeno. All'avvicinarsi della distranza dei due nuclei di idrogeno aumenta esponenzialmente l'energia potenziale del sistema, dovuto dalla presenza di cariche dello stesso segno molto vicine (
nucleo e
elettroni.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?