L'esperimento di Rutherford fu un approccio sperimentale attraverso il quale, agli inizi del XX secolo, si cercò di stabilire il tipo di struttura dell'atomo. Fu ideato e condotto, in larga parte, dal fisico e chimico inglese Ernest Rutherford. Il modello atomico di Thomson era, parallelamente al tempo storico dell'esperimento, quello più accreditato. Secondo questo modello, l'atomo è una struttura fortemente compatta e piena che non ha alcuno spazio libero all'interno.
La carica dell'atomo, secondo Thomson, è neutra poiché all'interno della struttura trovano posto sia i protoni, con carica positiva, sia gli elettroni, con carica negativa. La presenza, in egual quantità, di protoni ed elettroni rende la carica netta dell'atomo pari a zero, dunque neutro.
Ipotesi sperimentale
Rutherford ipotizzò che se l'atomo fosse effettivamente pieno avrebbe occupato gran parte della materia. Bombardando una lamina d'oro, con delle particelle alpha, un'altra lamina, definita rilevatore, formata da solfuro di zinco avrebbe visivamente mostrato un pattern regolare e pieno.
Risultati
La macchina utilizzata in laboratorio da Rutherford era molto semplice: un emettitore di raggi alpha veicolava un fascio verso la lamina d'oro. L'altra parte della lamina era rivestita dal solfuro di zinco che, se raggiunto dalla particella, mostra un tipico effetto ottico, rilevabile quindi dall'operatore.
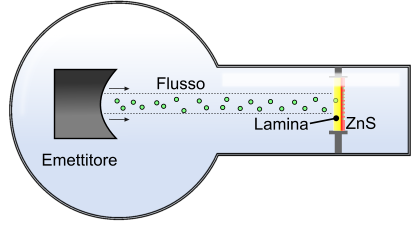
Schematizzazione dell'esperimento di Rutherford. La lamina d'oro al centro venne bombardata da particelle alpha, rilevate attraverso un'ulteriore lamina di solfuro di zinco. Il pattern non omogeneo impresso sulla lamina di solfuro di zinco lascia intendere che l'atomo non è compatto.
Fu molta la sorpresa di Rutherford quando osservò che il pattern sulla lamina di solfuro di zinco, anziché mostrare un profilo regolare, si rivelava con emissione disomogenea della luminescenza. Questa osservazione portò alla conclusione che l'atomo non deve essere compatto, ma è formato da una parte centrale, il nucleo e da un guscio elettronico esterno.
In particolare, una valutazione dell'esperimento, permise di definire che il nucleo, carico positivamente, riusciva a deviare il flusso di elettroni o, in base al tipo di impatto, respingerli.
Modello planetario
Rutherford, a seguito del suo esperimento, propose che l'atomo fosse simile a un sistema planetario con un corpo al centro, il nucleo, e dei pianeti che attorno ad esso ruotano, gli elettroni. Secondo il modello planetario, gli elettroni si muovono in orbite (il concetto di orbitale atomico non era ancora stato perfezionato) attorno al nucleo.
Esperimento di Rutherford e meccanica quantistica
L'esperimento di Rutherford servì da solida base per una serie successiva di osservazioni e di esperimenti atti a comprendere, in modo più raffinato, la struttura dell'atomo.
L'avvento della meccanica quantistica e del lavoro di Bohr, che in pochi anni rivoluzionò la concezione di atomo con il modello atomico di Bohr, misero in fortissima discussione il, seppur ingegnoso, risultato teorico che derivò dall'esperimento di Rutherford.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?