Il modello atomico di Rutherford è una costruzione teorica dell'atomo, che prende spunto dalle osservazioni sul modello atomico di Thomson, correggendo sperimentalmente alcuni tratti, specialmente negli ambiti che riguardano la suddivisione delle cariche. Nell'atomo di Thomson, infatti la carica netta dell'atomo è neutra poiché all'interno di esso coesistono particelle cariche negativamente e particelle cariche positivamente; questo modello è, per questa ragione, conosciuto come modello a panettone.
Questa teoria atomica fu, successivamente, analizzzata da Rutherford che, attraverso un esperimento, scoprì che le particelle dell'atomo sono spazialmente separate in base alla loro carica. All'interno trovano posto i cosiddetti nucleoni, quali i protoni e i neutroni, mentre all'esterno, nel guscio elettronico, orbitano gli elettroni. La differenziazione dello spazio, in base alla carica, spiega molte delle proprietà dell'atomo, ad esempio la conduzione dell'elettricità.
L'esperimento di Rutherford
Per verificare l'ipotesi di Thomson, inerente alla presenza in forma compatta dell'atomo, Rutherford condusse un semplice esperimento: bombardò con particelle alpha una lamina d'oro, all'esterno della quale vi era un rivelatore di particelle formato da solfuro di zinco (SnZn). Se l'atomo fosse compatto, il profilo di rilevazione sulla lamina di solfuro di zinco, avrebbe dovuto essere lineare ed uniforme, tuttavia Thomson visualizzò un profilo molto differente.
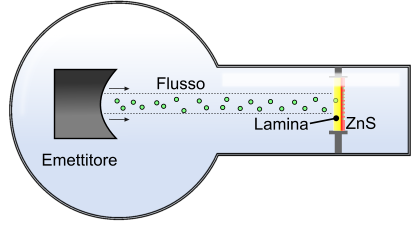
Esperimento di Rutherford con la lamina d'oro bombardata da particelle alpha.
Il profilo osservato non era uniforme, segno che parte degli elettroni era deviato da quello che, in realtà, è il nucleo. Una piccola parte, invece, rimbalza verso l'emettitore poiché impatta con lo stesso nucleo.
L'osservazione di Rutherford permise di determinare che il guscio elettronico era distante dal nucleo e, di conseguenza, la concezione stessa dell'atomo era da rivedere, perché non poteva essere compatto ma spazialmente diviso in divere unità. Inoltre, secondo Rutherford, le particelle con carica negativa ruotano in orbite predefinite attorno al nucleo, definendo così il modello planetario dell'atomo.
Limiti del modello atomico di Rutherford
Il modello atomico di Rutherford rappresenta, senza dubbio, un passo in avanti per la comprensione dei meccanismi che regolano le proprietà dell'atomo, anche in considerazione dei diversi elementi chimici. In particolare, l'osservazione che gli elettroni ruotino attorno al nucleo fu innovativa poiché permise di determinare molte delle proprietà atomiche, ad esempio quelle relative al legame chimico tra due o più elementi o alla conduzione dell'elettricità. Allo stesso modo, la possibilità che un elettrone potesse ruotare attorno al nucleo fu subito messa in discussione poiché, se all'elettrone fossero associate le leggi che governano la meccanica classica (conservazione della quantità di moto, energia cinetica, energia potenziale o energia in senso generale) non era possibile la sua esistenza nel tempo in tali termini.
Con l'avvento della meccanica quantistica all'atomo e, in misura maggiore, alle particelle che lo compongono, si associarono le proprietà dei quanti che illustrano, in modo sperimentalmente verificabile, molti degli aspetti criticati alla teoria atomica di Rutherford.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?