Il numero di ossidazione o stato di ossidazione, rappresenta un valore formale assegnato a un atomo presente singolarmente, in forma neutra oppure sotto forma di ione, oppure a un atomo che fa parte della struttura di una molecola. Il numero di ossidazione può essere qualsiasi numero intero, non decimale, positivo o negativo, zero compreso. Il numero di ossidazione è spesso abbreviato in N.O..
Dal punto di vista chimico, lo stato di ossidazione di un atomo, può essere considerato come la differenza tra il numero di elettroni di valenza e il numero residuo degli elettroni che rimangono liberi dopo che l'atomo ha instaurato un legame chimico.
Calcolo del numero di ossidazione
Il numero di ossidazione può essere agevolmente calcolato osservando il tipo di atomo, ione, o molecola. In linea generale, per determinare lo stato di ossidazione basta seguire alcune, semplici, regole.
- Negli elementi monoatomici (Fe, Zn, O, ...) lo stato di ossidazione è pari a zero.
- Nelle molecole omooatomiche, ad esempio nell'ossigeno molecolare (O2), il numero di ossidazione di ciascun atomo è pari a zero.
- Negli elementi monoatomici con carattere ionico, lo stato di ossidazione è pari alla carica dello ione, riportante lo stesso segno. Ad esempio, nel Fe++ il numero di ossidazione è 2 mentre nel Fe+++ il numero di ossidazione è pari a 3.
- Nelle molecole con carattere ionico, la somma algebrica dei numeri di ossidazione è pari alla carica ionica della molecola stessa. Ad esempio, nell'acetato (l'[anione]] dell'acido acetico) lo stato di ossidazione dell'ossigeno è pari a -1.
Esempio di calcolo dello stato di ossidazione: ione acetato
Lo ione acetato ha formula di struttura pari a CH3COO-. Espandendo la struttura è possibile, agevolmente, calcolare il numero di ossidazione dei singoli atomi che fanno parte della molecola. È importante osservare che il numero di ossidazione varia in base alla differenza di elettronegatività tra atomi adiacenti.
Numero di ossidazione nella molecola dell'acetato
| Numero di ossidazione ed elettronegatività |
Tabella di elettronegatività |
|---|
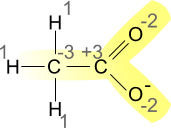
Calcolo del numero di ossidazione nello ione acetato, si considera per il calcolo il differente valore di elettronegatività degli atomi coinvolti.
|
Ossigeno (O): 3.44
Carbonio (C): 2.55
Idrogeno (H): 2.2 |
Ad esempio, nell'acetato, il carbonio legato a tre atomi di idrogeno possiede uno stato di ossidazione pari -3, mentre il carbonio del gruppo carbossilico possiede numero di ossidazione pari a +3. Questo perché gli atomi di ossigeno del carbonio carbossilico sono più elettronegativi del carbonio e, formalmente, attraggono gli elettroni. Nel legame carbonio-carbonio (R-C-C-R), un elettrone è idealmente distribuito tra i due atomi.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?