Lo stato solido è uno degli stati della materia caratterizzato dalla presenza di una densa struttura molecolare che determina una ottima resistenza alla compressione. I solidi, infatti, sono praticamente incomprimibili e possiedono una forma propria che è mantenuta nel tempo. In base alla struttura molecolare si classificano solidi amorfi o solidi regolari/cristallini.
Classificazione dei solidi
La classificazione chimica dei solidi si basa sul tipo di legame chimico che tiene unita la materia.
I solidi formati grazie all'azione del legame covalente, inoltre, si classificano in ulteriori sottotipi.
Classificazione dei solidi legati da legame covalente*
| Solido con legame covalente |
Tipo di formazione |
Esempio |
|---|
| Solidi molecolari |
Formati da molecole |
Anidride carbonica (CO2), Acqua |
| Solidi reticolari |
Formati da atomi disposti in modo regolare |
Carbonio, silicio |
| Solidi amorfi |
Formati da atomi, disposti in modo irregolare |
Vetro |
Proprietà dei solidi
La prima proprietà, facilmente osservabile in un qualsiasi solido è la capacità di mantenere stabile nel tempo una forma propria, a differenza della materia allo stato liquido o gassoso che, invece, necessita di un recipiente che la contenga. I solidi, inoltre, resistono alla compressione nel senso che, a meno che non possiedano strutture interne particolari, sono incomprimibili. Tuttavia, alcuni solidi possiedono alcune proprietà che consentono una limitata deformazione come la malleabilità e la duttilità.
La resistenza alla compressione non è da confondere con la resistenza alla rottura; tutti i solidi hanno, infatti, un punto di rottura (o punto di fatica) che determina la rispettiva resistenza a una forza comprimente concentrata in un solo punto, generalmente ridotto.
Struttura dei solidi
I solidi sono organizzati in strutture cristalline, ad esempio nel comune cloruro di sodio] (sale da cucina), gli atomi di sodio e di cloro si dispongono a formare un reticolo cristallino reso possibile dal legame ionico. I solidi cristallini sono strutture chimicamente ordiante, formate da sequenze ripetute, o pattern strutturali, di atomi o molecole tra loro legate. Le strutture amorfe, invece, non possiedono una sequenza ben definita e appaiono come agglomerati casuali di atomi o molecole.
Passaggi di stato verso lo stato solido
La solidificazione è il passaggio tra lo stato liquido e quello solido e avviene per diminuzione della temperatura o per aumento della pressione. La brinatura è il passaggio tra stato aeriforme a solido ed è mediato dalle stesse variazioni fisiche di temperatura e pressione che portano alla solidificazione.
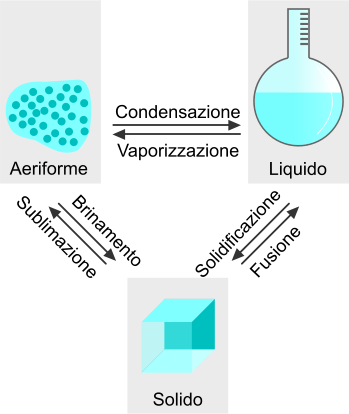
Passaggi di stato della materia.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?