La teoria dell'orbitale molecolare è una teoria che spiega gli eventi che portano alla formazione di un legame chimico, approfondendo allo stesso tempo la proprietà di alcune molecole di rispondere a un campo magnetico, attraverso l'attrazione. Il paramagnetismo, infatti, trova una spiegazione sperimentale nell'analisi dell'orbitale molecolare di una molecola.
Secondo la teoria dell'orbitale molecolare, durante gli eventi di formazione del legame covalente, si formano due tipi di orbitale molecolare: uno di legame, nel quale stazionano gli elettroni di legame e uno di antilegame, nel quale trovano posto gli elettroni di antilegame.
Gli elettroni di legame possiedono un'energia più bassa rispetto agli elettroni di antilegame e stabilizzano la molecola; qualsiasi sistema, infatti, è tanto più stabile quanto minore è l'energia da esso posseduto. Gli elettroni di antilegame, invece, possiedono un'energia maggiore e destabilizzano la molecola.
Regole da seguire nella costruzione di un orbitale
L'orbitale molecolare espande il concetto di orbitale atomico e, da esso, ne eredita lo schema di costruzione. Gli elettroni, innanzitutto, devono disporsi osservando la regola di Hund, quindi con spin parallelo fino alla saturazione degli orbitali e, successivamente, con spin antiparallelo. Allo stesso modo, devono osservare la regola di Aufbau e disporsi dapprima singolarmente all'interno dei sotto-orbitali a minor energia e poi lungo quelli a maggior energia.
Orbitale molecolare dell'idrogeno
L'idrogeno è un atomo con configurazione elettronica molto semplice: 1s1. La costruzione di un orbitale molecolare, relativo alla formazione dell'idrogeno molecolare (H2) è riportata nell'immagine sottostante.
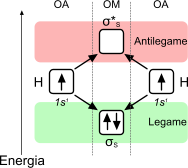
L'idrogeno molecolare presenta due elettroni nell'orbitale molecolare di legame e zero elettroni nell'orbitale molecolare di antilegame. Per questa ragione, l'ordine di legame è pari a 1 e la molecola, in accordo alla teoria, può formarsi.
Nell'idrogeno molecolare, i due elettroni si dispongono nell'orbitale molecolare a minor energia (σs), in accordo alla regola di Hund si dispongono con spin invertito, rispettivamente pari a +1/2 e -1/2. L'ordine di legame è pari a 1 e, di conseguenza, la formazione della molecola è accettabile.
Orbitale molecolare dell'elio
L'elio] è un gas nobile, la cui configurazione elettronica è pari a 1s2. In questo caso, la costruzione dell'orbitale molecolare riempie anche la zona di antilegame.
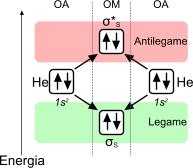
L'elio è un gas nobile, che non si lega ad altre molecole anche in accordo alla teoria dell'orbitale molecolare. Questo avviene poiché, l'energia del livello di antilegame, occupato da due elettroni, rende instabile la molecola che, per questo motivo, non si forma.
L'energia associata alla potenziale molecola di elio è elevata, in virtù della presenza di un doppietto elettronico nell'orbitale di antilegame. Inoltre, l'ordine di legame è pari a zero e, per questa ragione, la molecola non può, in accordo alla teoria, esistere giacché non è consentita la formazione di legami.
Orbitale molecolare dell'azoto molecolare
Gli orbitali atomici di tipo p possono, a loro volta, contribuire alla formazione di un orbitale molecolare. L'azoto molecolare, ad esempio, può essere così configurato come nell'immagine sottostante.
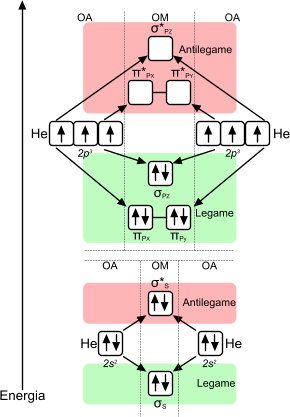
L'orbitale molecolare dell'azoto è costruito tenendo in considerazione l'orbitale atomico di tipo p. La molecola di azoto è accettata poiché l'ordine di legame è pari a 3
I tre legami formati dall'azoto molecolare derivano dal calcolo dell'ordine di legame nel quale si considerano tutti gli elettroni leganti, quindi anche quelli del livello energetico inferiore (non mostrato in figura), e gli elettroni antileganti (non mostrati in figura).
Orbitale molecolare dell'ossigeno molecolare
La configurazione elettronica dell'ossigeno è 1s22s22p4. La costruzione dell'orbitale molecolare è la seguente.
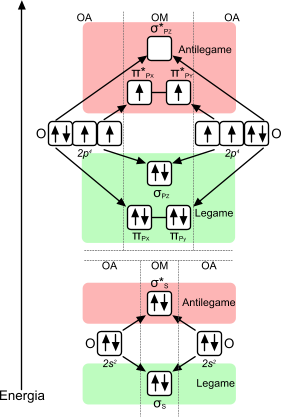
L'orbitale molecolare della molecola di ossigeno è caratterizzato dalla presenza di due elettroni nell'orbitale di antilegame
L'ordine di legame della molecola di ossigeno è pari a due e, nell'orbitale di antilegame sono presenti due elettroni. La presenza degli elettroni rende l'ossigeno una molecola paramagnetica, capace di orientarsi in modo ordinato in base alla direzione del campo magnetico. Il paramagnetismo cessa immediatamenta quando il campo magnetico non è più presente.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?