Il legame metallico è un tipo di legame chimico che si instaura tra gli elementi che fanno parte dei gruppi IA, IIA, IIIA e dei gruppi di transizione. Gli atomi, appartenenti a questi gruppi, si organizzano nella formazione di un reticolo cristallino la cui struttura è simile ai cristalli formati dall'interazione multipla tramite legame ionico, ma le proprietà finali della materia che, genericamente, viene definita metallo differiscono di molto rispetto ai cristalli di natura ionica.
Nel legame ionico la presenza di elementi differenti, ad esempio il cloro e il sodio, rende possibile la formazione di cationi e di anioni. I metalli sono formati da atomi uguali, agglomerati tra loro in modo da formare estese strutture. Un atomo non può avere, allo stesso tempo carica positiva, dunque cationica, e carica negativa, anionica. Per questa ragione, il modello teorico sul quale è basata la struttura metallica è totalmente differente.
Teoria del mare di elettroni
Secondo il modello più accreditato inerente al tipo di legame metallico, gli atomi che fanno parte di un metallo sono tutti cationi o ioni positivi. Gli elettroni sono donati al reticolo cristallino e stabilizzano la struttura. Questa teoria prende il nome di modello a mare di elettroni. Tra i cationi, dunque, vi è l'interposizione regolare degli elettroni che sono comunque liberi di fluire lungo il reticolo in modo ordinato.
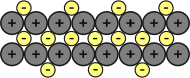
Modello a mare di elettroni: gli elettroni stabilizzano le cariche cationiche e rendono compatto il metallo.
La presenza degli elettroni rende il legame adirezionale e permette di illustrare alcune caratteristiche tipiche dei metalli:
- Eleveta conducibilità elettrica. Gli elettroni possono agevolmente spostarsi nel reticolo cristallino, permettendo la formazione di una corrente elettrica.
- Elevata conducibilità termica. I metalli sono ottimi conduttori di calore. L'energia somministrata al reticolo è trasferita agli elettroni che, a loro volta, la distribuiscono nelle zone limitrofe.
- Duttilità e malleabilità. È noto che i metalli presentano una certa capacità di deformarsi se sottoposti a sollecitazioni meccaniche quali la compressione o lo stiramento. Questo è possibile perché, a differenza dei solidi ionici, è possibile uno spostamento a livello della materia.
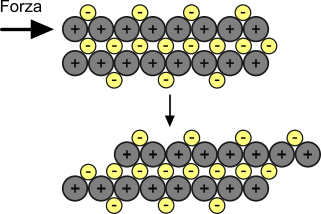
Duttilità e malleabilità nei metalli. Questi riarrangiamenti molecolari sono possibili grazie alla stabilità del reticolo cristallino in caso di spostamenti dei costituenti atomici interni.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?