Il modello atomico di Bohr rappresenta il frutto dello studio concettuale del fisico danese Niels Bohr e, successivamente da Arnorld Sommerfeld, che avvenne agli inizi del XX secolo. L'atomo di Bohr era molto diverso dai precedenti modelli atomici, in particolare rispetto a quanto proposto nel modello atomico di Rutherford.
L'enorme passo in avanti, proposto da Bohr, si associa a una diversa concezione delle particelle che compongono l'atomo. I nucleoni e gli elettroni, secondo i precedenti modelli atomici, erano regolati dalle leggi della meccanica classica ch ben si presta all'analisi delle particelle non atomiche ma non è capace di illustrare il comportamento delle particelle subatomiche. Bohr, attraverso il suo sistema teorico e sperimentale, propose che le leggi che governano le entità subatomiche, potessero far parte della meccanica quantistica, che diverge su molti dei punti della concezione classica della fisica.
La meccanica quantistica associata allle particelle subatomiche illustra, in modo sperimentalmente verificabile, le proprietà fisico-chimiche dell'atomo, specialmente per quanto concerne gli aspetti relativi all'energia, al moto degli elettroni.
Orbitali elettronici
La prima, importante, intuizione di Bohr fu quella relativa al moto degli elettroni attorno al nucleo atomico. La meccanica classica dimostra molti limiti al riguardo, e non è compatibile con il moto orbitale degli elettroni per diverse ragioni teoriche; la neonascente meccanica quantistica permise di variare la concezione di moto dell'elettrone che, di fatto, non orbita attorno al nucleo in orbite ben precise ma, utilizzando un sistema quantico, assume una probabilità di presenza in uno spazio ben delineato che è determinato dai numeri quantici.
La funzione d'onda al quadrato (ψ2) è utilizzata per la costruzione di uno spazio all'interno del quale si ha una densita di probabilità di rilevare un elettrone. In altre parole, non esiste un ideale tracciato nel quale l'elettrone orbita, ma una probabilità che, nello spazio attorno al nucleo, l'elettrone stesso possa trovarsi.
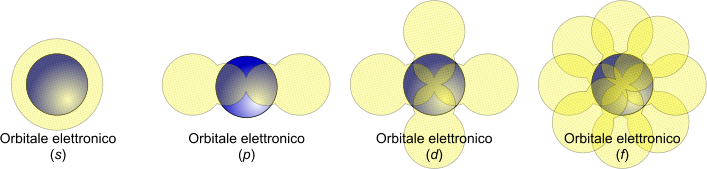
Orbitali atomici.
L'elettrone, nel suo moto, non perde energia e, per questa ragione, è libero di percorrere il proprio orbitale atomico in modo indefinito, almeno fino a quando un evento esterno non cambia il suo stato quantico. Ad esempio, la somministrazione di energia serve per promuovere un elettrone da uno strato a minore energia verso uno a maggiore energia operando un salto quantico.
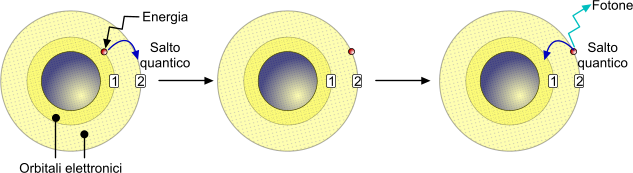
La somministrazione di energia verso un elettrone determina un momentaneo eccitamento dell'elettrone stesso, che a seguito di un salto quantico si posiziona in un orbitale a energia superiore. Il ritorno allo stato fondamentale porta all'emissione di un fotone.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?