L'acqua pura, allo stato liquido, è quantitativamente presente sotto forma di molecola di H2O. Tuttavia, sebbene in minima parte, alcune molecole di acqua si dissociano secondo il seguente equilibrio chimico.
$$H_{2}O\rightleftharpoons H^{+}+OH^{-}$$
L'equilibrio è conosciuto come autoprotolisi o autoionizzazione dell'acqua ed volutamente riportato in modo semplificato poiché, nella realtà, la dissociazione dell'acqua porta alla formazione di uno ione ossidrile (OH-) e di un idronio (H3O+). Al pari di tutti gli altri equilibri, è possibile calcolare una costante di dissociazione Kc.
Calcolo del prodotto ionico dell'acqua
A temperatura pari a 25°C la costante è così calcolata:
$$K_{c}=\frac{[H^{+}]\cdot [OH^{-}]}{[H_{2}O]} = 1.8 \cdot 10^{-16}$$
L'equilibrio è spostato verso sinistra poiché i reagenti sono presenti in quantità enormemente maggiore rispetto ai prodotti, rappresentati dagli ioni. Per questa ragione, la concentrazione dell'acqua si considera trascurabile. È possibile, adesso, scrivere l'espressione in forma semplificata:
$$K_{c} \cdot [H_{2}O]=[H^{+}]\cdot[OH^{-}]$$
La concentrazione molare dell'acqua è un valore costante e si calcola:
$$[H_{2}O] = \frac{n}{V}=\frac{\frac{1000}{18}}{1}=55.55mol/l$$
La concentrazione dell'acqua è inglobata nella Kc che, per questa ragione diventa Kw.
$$K_{w} =[H^{+}]\cdot[OH^{-}]{-14}$$
A questo punto, è possibile calcolare il prodotto ionico dell'acqua che vale 1·10-14 secondo l'equazione:
$$K_{w} =k\cdot[H_{2}O]=1.8\cdot10^{-16}\cdot55.55=1\cdot10^{-14}$$
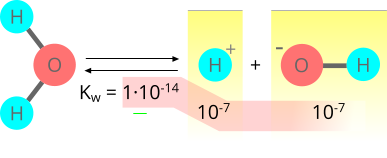
Prodotto ionico dell'acqua.
Soluzione acida, basica o neutra
Le molecole che formano l'acqua pura, sebbene raramente, a causa delle proprietà chimiche si dissociano in ioni OH- e H+ . Per ogni equivalente molecolare si formano un equivalente di OH- e un equivalente di H+.
Quando l'acqua è pura allora la concentrazione di ioni, che derivano dal prodotto ionico dell'acqua, obbedisce alla seguente relazione:
$$[OH^{-}]=[H^{+}]$$
Dunque, la concentrazione dei singoli ioni si calcola, altrattanto semplicemente, con:
$$x=\sqrt{K_{w}}=\sqrt{1\cdot10^{-14}}=1\cdot10^{-7}$$
Quando la concentrazione di H+ e di OH- è uguale la soluzione si definisce neutra; tuttavia quando per cause diverse la concentrazione di H+ prevale sulla concentrazione di OH- allora la soluzione si definisce acida, viceversa - quando sono gli ioni OH- a prevalere - la soluzione è definita basica.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?