Il protone è una particella subatomica che fa parte del nucleo, dell'atomo. Ha una carica positiva che bilancia la carica negativa dell'elettrone. È una particella perenne, non decomponibile e determina, in un atomo, il cosiddetto numero atomico. All'aumentare del numero di protoni aumenta il numero atomico dell'elemento.
L'isotopo prozio dell'idrogeno è formato da un solo protone che costituisce il ncucleo centrale.
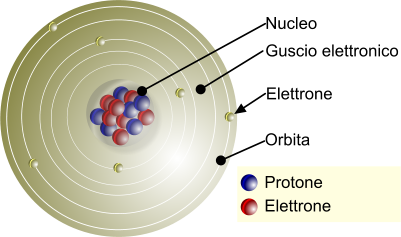
Struttura semplificata dell'atomo. I protoni fanno parte del nucleo centrale.
Scoperta del protone
Il chimico Ernest Rutherford, fu il primo a teorizzare la presenza di una particella subatomica che definì protone. Sfruttando le conoscenze relative alla radioattività, il chimico tedesco cercò di verificare sperimentalmente il volume del nucleo e, di conseguenza, stimare la dimensione relativa dei componenti nucleari (protoni e neutroni) rispetto all'intero atomo, comprensivo del guscio esterno di elettroni, conosciuto anche come guscio elettronico. Utilizzando una tecnica simile alla fotografia a raggi X (radiografia), Rutherford teorizzò che il volume del nucleo, e delle relative particelle, era inferiore rispetto al volume dell'atomo. A seguito di questa osservazione, propose che protoni ed elettroni fossero tra loro distanti e, gli elettroni, ruotassero attorno al nucleo in un sistema detto a moto planetario.
Caratteristiche chimiche
La carica elettrica del protone è simile a quella dell'elettrone ma con segno inverso. Il protone è carico positivamente ed ha una carica di 1.602·10-19C.
Particelle elementari
Il protone è formato da tre particelle elementari, definite quark: due quark up e un quark down. I quark up possiedono una carica positiva, a differenza del quark down che la possiede negativa. La maggiore influenza dei quark up determina una carica netta positiva del protone.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?