In chimica, un solvente è una uno ione, atomo o molecola che possiede la capacità di disciogliere altri ioni, atomi o molecole. Il solvente è sempre allo stato liquido, mentre le molecole che nel solvente si sciolgono possono essere sia allo stato liquido, sia aeriforme (ad esempio un gas), sia allo stato solido. La molecola disciolta prende il nome di soluto.
Il ruolo dei solventi è importante tanto in chimica quanto, generalmente, nella biologia. Ad esempio, nel sangue il solvente acquoso rende possibile il trasporto dei nutrienti che, di fatto, si trovano ad essere disciolti nel plasma. I solventi, inoltre, sono molto importanti a livello industriale poiché, grazie ad essi, è possibile operare delle reazioni chimiche utili per la lavorazione o la raffinazione di diversi materiali.
Meccanismo d'azione
Il solvente è capace di disciogliere il soluto, oppure i soluti, grazie alla formazione di molti legami deboli attraverso i quali il soluto è capace di solubilizzare. La natura debole del legame rende possibile la reversibilità dei legami e l'allontanamento del solvente, di solito agendo sulla temperatura del sistema.
Classificazione dei solventi
I solventi sono classificati in base alla loro polarità, che deriva da una eguale o diseguale distribuzione delle cariche elettriche lungo le rispettive particelle che formano il solvente stesso. Inoltre, i solventi polari si distinguono in solventi polari protici, se presentano un atomo di idrogeno capace di dissociarsi in H+, o solventi polari aprotici qualora il solvente non presenti idrogeni liberi capaci di dissociarsi.
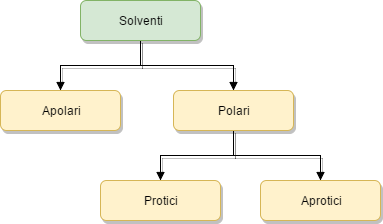
Classificazione dei solventi in solventi polare e solventi apolari.
Classificazione dei solventi in base alla polarità
| Tipo di solvente |
Esempio |
|---|
| Solvente polare aprotico |
Acetone, acetonitrile, dimetilsolfossido. |
| Solvente polare protico |
Acqua, acido acetico, isopropanolo, etanolo, metanolo, acido formico. |
| Apolare |
Benzene, esano, toluene, cloroformio, acetato di etile, cloruro di metilene. |
I solventi polari disciolgono soluti polari, mentre solventi apolari disciolgono soluti apolari. Per questa ragione, durante la scelta di un solvente si applica la regola del "simile scioglie il simile".
Caratteristiche dei solventi
I solventi possiedono delle peculiari caratteristiche chimiche e fisiche. Un solvente, infatti, possiede quasi sempre un basso punto di ebollizione e permette di essere distillato affinché i soluti possano essere recuperati. Adesempio, in una miscela è possibile allontanare il solvente mediante l'aumento della temperatura del sistema e rinvenire i soluti precedentemente disciolti nella soluzione.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?