Il legame covalente è un tipo di legame chimico nel quale due, o più atomi mettono in compartecipazione una o più coppie di elettroni per raggiungere una formazione stabile. Esistono differenti tipi di legame covalente che tengoono conto sia del numero di doppietti elettronici coinvolti, sia degli atomi legati. Il legame chimico, a tal proposito, può instaurarsi tra due atomi appartenenti allo stesso elemento (ad esempio nell'ossigeno molecolare O2) oppure tra due elementi diversi (ad esempio nell'acido cloridrico HCl).
La formazione di un legame covalente porta alla formazione di un orbitale molecolare, che è rappresentato da una zona dello spazio nel quale vi è una certa probabilità di trovare gli elettroni di legame in un determinato istante.
Da un punto di vista termodinamico, la possibilità di formazione del legame è spiegata dal passaggio a minor energia della molecola, rispetto all'energia potenziale totale in possesso dei singoli atomi. Una configurazione molecolare a minor energia è sempre più stabile di una singola conformazione atomica a maggior energia. In natura, qualsiasi sistema tende a "cedere" energia verso l'esterno per permanere nel tempo in uno stato a bassa energia.
Nel legame covalente dativo, la compartecipazione è diversa poiché un atomo dona il doppietto elettronico, mentre l'altro atomo dona l'orbitale nel quale il doppietto può permanere.
Lunghezza di legame
La formazione di un legame covalente non è sempre possibile, poiché vi sono delle regole da rispettare. Innanzitutto, gli atomi devono essere abbastanza vicini per permettere la compartecipazione degli elettroni. La distanza tra i due atomi - che possono anche far parte delle molecole - prende il nome di distanza di legame o lunghezza di legame. Ad esempio, nell'idrogeno molecolare, la distanza di legame è pari a 1.06Å.
La lunghezza di legame ottimale deriva dalle proprietà chimiche e fisiche del sistema e degli elementi interessati. Gli atomi, idealmente, sono formati da una parte interna (il |nucleo) e da un [[guscio elettronico esterno. Il nucleo, in virtù dei protoni presenti è carico positivamente, mentre il guscio elettronico è carico negativamente.
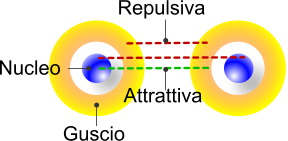
La formazione di un legame covalente tiene conto delle forze attrattive e repulsive operate dal nucleo verso gli elettroni (attrattive), dai nuclei degli atomi coinvolti (repulsive) e dagli elettroni degli atomi coinvolti (repulsive).
Gli elettroni sono attratti dal nucleo a causa della differente causa elettrica, e viceversa, il nucleo respinge l'altro nucleo e il guscio elettronico respinge l'altro guscio elettronico.
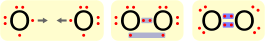
Affinché possa crearsi un legame covalente, di qualsiasi ordine sia, è necessario che i due atomi siano abbastanza vicini tra loro in modo tale da superare le forze repulsive e far prevalere le forze attrattive. Nell'ossigeno molecolare, ad esempio, due atomi di ossigeno mettono in compartecipazione due elettroni in totale per raggiungere la configurazione stabile.
In base al numero di doppietti condivisi varia l'ordine di legame; la condivisione di un singolo doppietto porta alla formazione di un legame covalente singolo con ordine di legame pari a 1. Due coppie condivise di elettroni formano un legame covalente doppio, con ordine di legame pari a 2.
Tipi di legame covalente
|
Tipo |
Ordine di legame |
|---|
 |
Singolo |
1 |
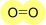 |
Doppio |
2 |
 |
Triplo |
3 |
Proprietà associate al legame covalente
Il legame covalente mostra alcune intrinseche proprietà, che ne definiscono gli attributi chimico-fisici. Innazitutto, in base al numero di doppietti elettronici si classificano legami singoli, doppi, tripli e quadrupli. Il numero di doppietti elettronici, inoltre, si riflette sulla lunghezza di legame che diminuisce all'aumentare dell'ordine di legame. Un legame doppio, ad esempio, possiede una distanza di legame inferiore rispetto a un legame singolo. Tuttavia, la distanza di legame non influenzata esclusivamente dall'ordine di legame, ma anche il bilancio netto tra le forze di attrazione e quelle di repulsione.
Legame covalente puro o omopolare
Quando un legame associa due atomi appartenenti alla stessa specie si forma un legame omopolare o legame puro. Questo accade perché la differenza di elettronegatività tra qualsiasi molecola omoatomica sarà sempre zero. Ad esempio, l'elettronegatività dell'idrogeno è pari a 2.2, mentre quella dell'ossigeno è pari a 3.4. L'idrogeno molecolare, e l'ossigeno molecolare, hanno un valore di elettronegatività netto pari a zero poiché, rispettivamente, 2.2 - 2.2 = 0 e 3.4 - 3.4 = 0. La molecola, in questo caso si definisce omopolare e non presenta un dipolo molecolare.
Legame covalente polare
Quando due o più atomi, uniti attraverso un legame covalente, appartengono a elementi diversi è molto probabile che la loro elettronegativià sia altrettanto diversa. Il bilanciamento delle cariche non è esattamente centrato e si viene a formare un dipolo. In un dipolo, la carica non è equamente distribuita e gli elettroni si spostano verso l'estremità maggiormente elettronegativa. La presenza di una maggiore concentrazione di elettroni rende la molecola polare.

Nella molecola dell'acqua l'ossigeno è maggiormente elettronegativo e tende ad attirare a sé gli elettroni di legame. In questo modo, la simmetria della carica della molecola è sbilanciata verso l'ossigeno. Per questa ragione la molecola d'acqua, esattamente come altre molecole formate da atomi con diversa elettronegatività, è classificabile come una molecola polare.
L'atomo che trattiene maggiormente gli elettroni acquisisce una parziale carica negativa, mentre l'atomo che rilascia gli elettroni acquisisce una parziale carica positiva. Graficamente, la carica positiva e negativa è rappresentata con la lettera greca delta (δ+ e δ-)
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?