La legge di Boyle è una legge fisica che illustra la trasformazione isoterma, dunque a temperatura costante, di un gas. L'osservazione sperimentale ha permesso di verificare che questa legge si adatta in modo sufficientemente preciso ai gas ideali. Secondo questa legge, il volume è una variabile di stato determinato, in maniera diretta, dalla pressione che, a sua volta, rappresenta una seconda variabile di stato.
Definizione della legge di Boyle
Per le ragioni appena esposte, la definizione della legge di Boyle è la segunte:
"A temperatura costante il volume occupato da una massa di gas diminuisce in modo proporzionale alla pressione"
Rappresentazione grafica della legge di Boyle. Aumentando la pressione, a temperatura costante, il volume si riduce in modo inversamente proporzionale alla pressione applicata.
L'equazione che deriva dalla correlazione delle variabili di stato è la seguente:
$$PV = k$$
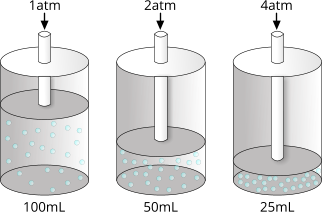
In effetti, è possibile verificare sperimentalmente l'equazione sopra riportata analizzando il volume di un gas sottoposto a differenti pressioni.
Legge isoterma dei gas
| Pressione |
Volume |
k = P ⋅ V |
|---|
| 1atm |
100ml |
100 |
| 2atm |
50ml |
100 |
| 4atm |
25ml |
100 |
| 8atm |
12.5ml |
100 |
| 16atm |
6.25 |
100 |
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?