La legge di Charles o prima legge di Gay-Lussac descrive il comportamento di un gas durante una trasformazione a pressione costante, o trasformazione isobara. Le osservazioni sul comportamento del gas, e delle rispettive variabili di stato, hanno permesso di definire con certezza la variazione della temperatura e del volume in un sistema nel quale la pressione del gas rimane costante.
Definizione della legge di Charles
La definizione relativa alla legge di Charles/Gay-Lussac, relativa a un gas a pressione costante, con temperatura misurata in Kelvin è la seguente:
"Il volume occupato da una quantità di gas diminuisce di 1/273 del volume da esso occupato a 0°C per ogni grado di variazione, in un sistema a pressione costante"
$$V=V_{0}+\frac{1}{273}\cdot t$$
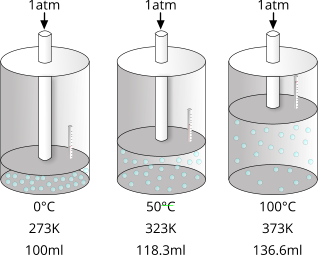
Durante una trasformazione isobara, la temperatura di un gas dipende dalla pressione alla quale esso è sottoposto, e viceversa.|alt
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?