Una reazione di ossidoriduzione o reazione redox o, semplicemente, ossidoriduzione è una reazione chimica nella quale i reagenti, normalmente molecole o atomi, vanno incontro a processi di ossidazione o di riduzione che determinano lo spostamento di elettroni da e verso le specie coinvolte. Una reazione redox è, in altre parole, un riarrangiamento bilanciato di elettroni tra le specie coinvolte in una reazione chimica. La definizione di reazione di ossidoriduzione è, per questo motivo, limitata allo spostamento di elettroni anche se, nella pratica comune, le molecole si possono riarrangiare anche nella forma oppure nel loro stato della materia iniziale o finale.
Tutte le reazioni chimiche sono reazioni di ossidoriduzione e, in esse, si distinguono specie ossidanti e specie riducenti e, allo stesso tempo, le specie sono ridotte e ossidate.
Ossidanti e riducenti
Nelle reazione redox, una molecola o un atomo si ossidano quando cedono elettroni, mentre si riducono quando li ricevono. L'acquisto di elettroni determina una riduzione della carica ionica, ad esempio la riduzione del ferro ferrico (Fe3+) diminuisce la carica formale portandolo a ferro ferroso (Fe2+).
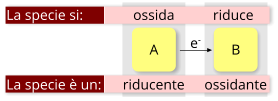
Reazione di ossidoriduzione: la specie che dona elettroni è la specie riducente, mentre la specie che li riceve è la specie ossidante. Viceversa, la specie donatrice si ossida, e la specie ricevente si riduce.
Semireazioni in una reazione di ossidoriduzione
Qualsiasi reazione redox è idealmente divisibile in due semireazioni, definite rispettivamente semireazione di ossidazione e semireazione di riduzione. Attraverso le semireazioni è agevole osservare il flusso di elettroni da una specie ad un'altra. Ad esempio, la reazione:
A + B → An+ + Bn-
può essere idealmente suddivisa nel seguente modo:
Semireazioni di ossidoriduzione
| Semireazione |
Descrizione |
|---|
| A → A+ ne- |
Ossidazione della specie A |
| B + ne- → Bn- |
Riduzione della specie B |
Spiegazione dell'ossidoriduzione
Una volta chiarito che, per definizione di ossidoriduzione, si intende il trasferimento di elettroni da specie a specie è necessario capire quale specie si è ossidata o ridotta. Nella pratica comune, esistono due metodi:
- Osservazione, attraverso un'analisi veloce della reazione è agevole individuare le specie che si sono formate/dissolte e che hanno subito ossidoriduzione;
- Analisi del numero di ossidazione, mediante il calcolo del numero di ossidazione è possibile qualitativamente stabilire quali specie hanno subito ossidoriduzione e quantitativamente ottenere informazioni sui termini della cessione o dell'acquisto degli elettroni.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?