Una sostanza pura è un insieme di particelle che presentano le stesse proprietà fisiche e chimiche poiché fanno parte della stessa specie particellare chimica (ione, atomo o molecola). Ad esempio, l'acqua distillata è una sostanza pura poiché è formata da un insieme di molecole di acqua presenti in un determinato stato della materia.
In chimica, le sostanze pure sono di riferimento sia per gli esperimenti scientifici sia per le sintesi industriali.
Caratteristiche delle sostanze pure
Le sostanze pure possiedono differenti caratteristiche che servono anche per la loro classificazione. L'acqua pura, ad esempio, possiede un punto di fusione pari a 0°C e un punto di ebollizione pari a 100°C a pressione costante e atmosfera standard (760mmHg). Indipendentemente dalla quantità di acqua, e dunque dal volume occupato, qualsiasi quantitativo di acqua pura avrà sempre le medesime proprietà.
A differenza delle miscele o delle soluzioni, una sostanza pura non può essere ulteriormente frazionata, dunque non può essere separata in due sostanze diverse utilizzando alcuna tecnica chimica o fisica. Le miscele e le soluzioni, invece, possono essere separate sfruttando alcune tecniche specifiche.
Differenza tra sostanza pura e soluzione
Una soluzione è formata da una miscela di due o più sostanze pure, la sostanza pura presente in maggior quantità, dunque quella che presenta la maggiore frazione molare, si definisce solvente mentre le altre specie presenti sono definite soluti.
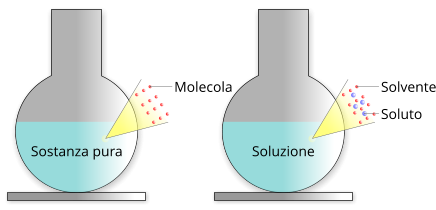
Differenza tra una miscela di sostanze e una sostanza pura.
Pagine correlate
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?