L'energia di ionizzazione è la quantità di energia necessaria a strappare un elettrone esterno, prelevandolo dal guscio elettronico di un atomo, presente in forma gassosa e in quantità pari a una mole, affinché lo stesso possa diventare un catione monovalente. La quantità di energia necessaria è espressa in kJoule/mol. Quando l'energia richiesta serve per la formazione di un catione monovoalente l'energia è anche definita energia di prima ionizzazione. Il valore dell'energia di ionizzazione è sempre positivo.
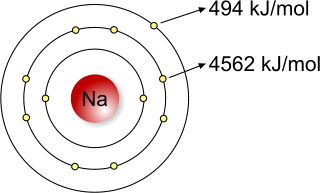
L'energia di prima ionizzazione del sodio è inferiore rispetto all'energia di seconda ionizzazione poiché è più difficile strappare un elettrone più vicino al nucleo.
Energia di seconda ionizzazione
L'energia di seconda ionizzazione è l'energia richiesta per strappare un secondo elettrone, più esterno rispetto al centro del nucleo. È sempre maggiore rispetto all'energia di prima ionizzazione poiché la forza che lega l'elettrone al più vicino nucleo è maggiore rispetto agli elettroni più esterni e, dunque, più lontani dal nucleo stesso. La somministrazione del quantitativo sufficiente per far avvenire la seconda ionizzazione porta alla formazione di un catione bivalente.
Proprietà periodiche dell'energia di ionizzazione
L'energia di ionizzazione possiede alcune proprietà periodiche che, in altre parole, sono ricorrenti nella tavola periodica degli elementi . In genere, l'energia di ionizzazione cresce da sinistra verso destra, osservando il periodo, mentre cresce dal basso verso l'alto nel gruppo.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?