Lo stato liquido è uno stato della materia nel quale le molecole che formano la materia, pur interagendo tra loro, non sono capaci di dare una forma definita alla stessa. Per questa ragione, i liquidi tendono a disporsi, anche in accordo alla forza di gravità, occupando la massima superfice disponibile. I liquidi, se sottoposti a pressione all'interno di un recipiente, ad esempio la pressione generata dallo stantuffo in una siringa piena di liquido, offrono un'ottima resistenza e, per questa ragione, si definiscono scarsamente comprimibili.

Qualsiasi liquido tende ad espandersi fino ad assumere la forma del recipiente che lo contiene.
Classificazione dei liquidi
I liquidi si classificano, in prima analisi, in base al tipo di legame che tiene unite le molecole o gli atomi costituenti e in base alla tendenza a evaporare o volatilizzare. I liquidi volatili sono formati da molecole legate tra loro attraverso un legame debole intermolecolare; l'acqua è un classico esempio di liquido volatile. I liquidi non volatili, invece, sono caratterizzati da un legame molecolare più forte e stabile; un esempio di liquido non volatile, stabile a temperatura ambiente, è il mercurio liquido.
Proprietà dei liquidi
I liquidi possiedono alcune peculiari caratteristiche fisiche e chimiche. Le caratteristiche fisiche determinano la permanenza in uno stato e la capacità di adattarsi nello spazio e sono, generalmente, tipiche per tutti i liquidi.
- Incomprimibilità, se sottoposti a pressione resistono alla compressione, non variando, se non sensibilmente, il proprio volume.
- Fluidità, i liquidi presentano una ridotta coesione tra le molecole che si traduce in un differente grado di viscosità, che dipende il larga misura dalla costituzione del liquido stesso, dalla pressione e dalla temperatura. I liquidi offrono una bassa resistenza allo scorrimento e si definiscono, per questa ragione fluidi.
- Elasticità, i liquidi sono elastici poiché assumono la forma del recipiente che li contiene e, in spazio aperto, reagiscono a forze di compressione adattandosi attraverso la deformazione. Non vi è, invece, modo di stirare un liquido.
Le caratteristiche chimiche, invece, sono determinate il larga parte dal tipo di liquido e dalla sua composizione.
- La volatilità, è la tendenza di una sostanza, presente allo stato liquido, ad evaporare.
- Il punto di ebollizione è il valore di temperatura nel quale il liquido passa dallo stato liquido a quello aeriforme.
Liquefazione e condensazione
La liquefazione e la condensazione rappresentano due passaggi di stato, rispettivamente dallo stato solido e aeriforme, nei quale si assiste nella trasformazione di altri stati di materia verso lo stato liquido. La liquefazione e la condensazione dipendono dalla variazione della temperatura e della pressione.
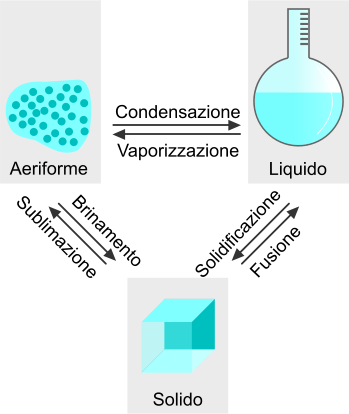
Passaggi di stato della materia verso lo stato liquido.
L'atomo e la sua struttura: Nucleo (protone, neutrone) e guscio esterno (elettrone).
Proprietà dell'atomo: Numero atomico, numero di massa, peso atomico, raggio atomico.
Specie chimiche: Ossidi.
Meccanica quantistica dell'elettrone: Ipotesi di De Broglie, orbitale atomico, numero quantico principale, numero quantico secondario, spin, salto quantico.
Configurazione elettronica: ibridizzazione sp3, ibridizzazione sp2, ibridizzazione sp, struttura di Lewis.
Legame chimico: Legame debole, legame ionico, legame metallico. Regola dell'ottetto, legame covalente, legame covalente dativo, energia di legame.
Stato della materia: Solido, liquido, aeriforme (gas).
Chimica delle soluzioni: Soluzione (solvente e soluto), concentrazione (molarità , normalità , frazione molare). Idrolisi, prodotto ionico dell'acqua.
Equilibrio chimico: Legge di azione di massa, costante di equilibrio.
Feedback
Il tuo aiuto è importante. Ti chiediamo un minuto per rispondere a questo breve sondaggio
Come valuteresti questo articolo?
Vuoi suggerirci qualcosa?